
| ||
| ||


科目:初中化学 来源: 题型:
| ||
| A、O2 |
| B、K2O |
| C、CO |
| D、CO2 |
查看答案和解析>>
科目:初中化学 来源: 题型:
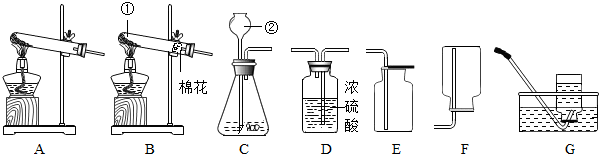
 (1)写出图中标有字母的仪器的名称:a
(1)写出图中标有字母的仪器的名称:a查看答案和解析>>
科目:初中化学 来源: 题型:
 (1)某元素是人体中的常量元素,它在人体内99%存在于骨骼和牙齿中.该元素的原子结构示意图如图,则x为
(1)某元素是人体中的常量元素,它在人体内99%存在于骨骼和牙齿中.该元素的原子结构示意图如图,则x为查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
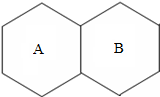 现有A、B、C、D四种物质分别是纯铁片、稀硫酸、碳酸钠溶液、氯化钡溶液中的一种,用四个六边形表示四种物质,用相邻的六边形有共同的边表示两种物质可以发生反应,请回答下列问题:(已知金属钡的金属活动性在钾和钙之间)
现有A、B、C、D四种物质分别是纯铁片、稀硫酸、碳酸钠溶液、氯化钡溶液中的一种,用四个六边形表示四种物质,用相邻的六边形有共同的边表示两种物质可以发生反应,请回答下列问题:(已知金属钡的金属活动性在钾和钙之间)查看答案和解析>>
科目:初中化学 来源: 题型:
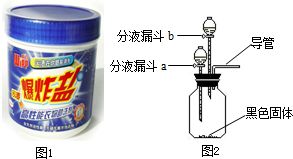
| 序号 | 主要操作步骤 | 主要实验现象 | 操作目的 |
| ① | 在集气瓶中加入少量MnO2(黑色固体);在分液漏斗a中加入新配制的“污渍爆炸盐”的饱和水溶液;在分液漏斗b中加入 |
||
| ② | 打开分液漏斗a的活塞,放出适量溶液后,关闭活塞. | 生成大量无色气体. | |
| 然后 |
验证生成气体的成分. | ||
| 第②步操作得到的结论: | |||
| ③ | 待②步反应停止后,打开分液漏斗b的活塞,放出适量溶液后,关闭活塞. | 生成大量无色气体. | |
| 将生成的气体通入 |
验证生成气体的成分. | ||
| 第③步操作得到的结论: | |||
| 序号 | 加入稀盐酸的质量/克 | 剩余固体的质量/克 |
| 第一次 | l0 | 5.5 |
| 第二次 | l0 | m |
| 第三次 | 10 | 1.2 |
| 第四次 | 10 | l.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com