
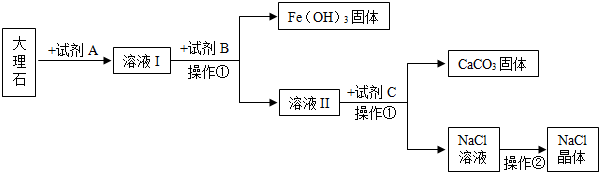
分析 (1)操作②是从氯化钠溶液中获得氯化钠晶体,进行分析解答.
(2)某大理石中的主要杂质是氧化铁,碳酸钙、氧化铁均能与稀盐酸反应,碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,氧化铁与稀盐酸反应生成氯化铁和水,氯化铁与氢氧化钠溶液反应生成氢氧化铁沉淀和氯化钠,氯化钙与碳酸钠溶液反应生成碳酸钙沉淀和氯化钠,进行分析解答.
(3)根据题意,某大理石中的主要杂质是氧化铁,进行分析解答.
解答 解:(1)操作②是从氯化钠溶液中获得氯化钠晶体,氯化钠的溶解度受温度的影响变化不大,可采用蒸发结晶的方法,操作②是蒸发;该操作用到的仪器有:玻璃棒、酒精灯、铁架台与蒸发皿.
(2)某大理石中的主要杂质是氧化铁,碳酸钙、氧化铁均能与稀盐酸反应,碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,氧化铁与稀盐酸反应生成氯化铁和水,故试剂A是稀盐酸,其化学式是HCl;氯化铁与氢氧化钠溶液反应生成氢氧化铁沉淀和氯化钠,氯化钙与碳酸钠溶液反应生成碳酸钙沉淀和氯化钠,试剂C是碳酸钠,俗称是纯碱或苏打.
该试剂与溶液II反应,即氯化钙与碳酸钠溶液反应生成碳酸钙沉淀和氯化钠,反应的化学方程式为:CaCl2+Na2CO3═CaCO3↓+2NaCl.
(3)原大理石主要成分是碳酸钙,但含有氧化铁等杂质,属于混合物,此工艺最后得到的碳酸钙是纯净物.
故答案为:(1)蒸发;蒸发皿;(2)HCl;纯碱或苏打;CaCl2+Na2CO3═CaCO3↓+2NaCl;(3)此工艺最后得到的碳酸钙是纯净物,原大理石是混合物.
点评 本题难度不大,理解工业上由大理石制备碳酸钙的主要流程图,掌握盐的化学性质、物质分离的方法等是正确解答本题的关键.


科目:初中化学 来源: 题型:选择题
| A. | 用于提高钢铁的产量和质量 | B. | 氧炔焰用来焊接或切割金属 | ||
| C. | 液氧制成炸药,用来开山采矿 | D. | 液氧可用作宇宙火箭的燃料 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 分子间有间隔 | |
| B. | 分子是保持物质化学性质的最小粒子 | |
| C. | 分子在不停地运动着 | |
| D. | 同种物质的性质相同 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Na2O | B. | CuSO4•5H2O | C. | NaCl | D. | SO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用一盏燃着的酒精灯点燃另一盏酒精灯 | |
| B. | 闻盐酸的气味时,鼻孔应位于试剂瓶口的正上方 | |
| C. | 氢氧化钠沾到皮肤上,要立即用大量的水冲洗,再涂上3%~5%的硼酸溶液 | |
| D. | 取块状药品时,如果没有镊子可以用手拿 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 实验室制取气体时,先装药品,再检查装置的气密性 | |
| B. | 用10mL量筒量取8.5mL某溶液 | |
| C. | 用托盘天平称量药品时,先调节天平平衡,再称量 | |
| D. | 没说明用量时,用试管取用液体药品的体积一般为1~2mL |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 方案 | 方法步骤 | 实验现象 | 实验结论 |
| 方案一 | 取少量烧杯内的溶液于试管中, 滴入几滴无色酚酞溶液 | 酚酞不变色 | 猜想一正确 |
| 酚酞变红色 | 猜想二正确 | ||
| 方案二 | 取少量烧杯内的溶液于试管中, 逐滴加入碳酸钠溶液至过量 | 先有气泡冒出,然后会有沉淀 | 猜想三正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com