
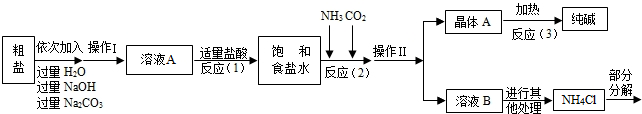
某同学根据“侯氏制碱法”的原理采用如下步骤制取少量纯碱:
Ⅰ、制取CO2;
Ⅱ、将CO2通入氨气饱和的饱和食盐水(NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl);
Ⅲ、过滤并干燥滤纸中的固体物质(NaHCO3);
Ⅳ、加热碳酸氢钠(2NaHCO3=Na2CO3+H2O+CO2↑).
(1)写出用盐酸与石灰石制取CO2的化学方程式:________.
(2)步骤Ⅲ所得的滤液中主要含有NaCl和NH4Cl.下图两者的溶解度曲线.根据溶解度曲线回答:
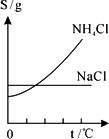
①哪种物质的溶解度随温度变化大?答:________.
②降低滤液的温度,NH4Cl晶体大量析出,而NaCl却仍留在溶液中.为什么?
答:________.
科目:初中化学 来源: 题型:阅读理解
| 实验步骤 | 实验现象 | 实验结论 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| 106 |
| 100 |
| x |
| 10.00g |
| 10.6g |
| 13.25g |
| 106 |
| 100 |
| x |
| 10.00g |
| 10.6g |
| 13.25g |
| a |
| b |
| 53 |
| 22 |
| 53 |
| 22 |
| a |
| b |
| 53 |
| 22 |
| 53 |
| 22 |
| a |
| b |
| 53 |
| 22 |
| a |
| b |
| 53 |
| 22 |
| 53b |
| 22a |
| 53b |
| 22a |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| 主要成分(mg/L): 碳酸氢根(HCO3-):173-205 氯离子(Cl-):1.0-8.0 硫酸根(SO42-):16.08-19.52 钠离子(Na+):8-50 镁离子(Mg2+):2.5-12.5 PH值:7.8±0.5①“SO42-”中数字“2”的含义是 每个硫酸根离子带两个单位的负电荷 每个硫酸根离子带两个单位的负电荷 .②该矿泉水显 碱 碱 性(填“酸”、“碱”或“中”).③日常生活中用 肥皂水 肥皂水 区别软水和硬水,可通过煮沸 煮沸 方法降低水的硬度.(5)今年5月20日是第23个“中国学生营养日”,主题是:“全面、均衡、适量--培养健康的饮食行为”.请你用所学的化学知识关注同学们的营养问题. 我市某学校的学生食堂午餐提供的食谱为:大米饭、豆腐干炒肉、骨头蛋汤. ①以上食物中为我们提供的营养素有糖类、 蛋白质 蛋白质 ,油脂、无机盐和水.②考虑到中学生身体发育对各种营养素的需要,你认为食堂还应增加的一种食物是 B B ;(填编号).A.红烧肉 B.青菜 C.红烧鱼块 D.油炸馒头. ③下列说法正确的是 B B A.大量使用食品添加剂,不会对人体造成伤害 B.幼儿及青少年缺钙会得佝偻病 C.出售海产品时,为了延长保鲜期可以用甲醛溶液浸泡 D.霉变的大米经过淘洗可放心食用. ④食堂常使用铁强化酱油,酱油中加铁强化剂是为了防止-- (6)我国化工专家侯德榜探索发明的“侯氏制碱法”,其生产过程涉及的主要化学反应如下: ①NH3+C02+X=NH4HC03 ②NH4HC03+NaCI═NH4Cl+NaHC03↓ ③2NaHC03
请回答: (1)反应①中X的化学式为 H20 H20 ;(2)NH4Cl中N元素的化合价为 -3 -3 价;(3)除去混在Na2C03粉末中少量的NaHC03的方法是 加热混合物 加热混合物 .
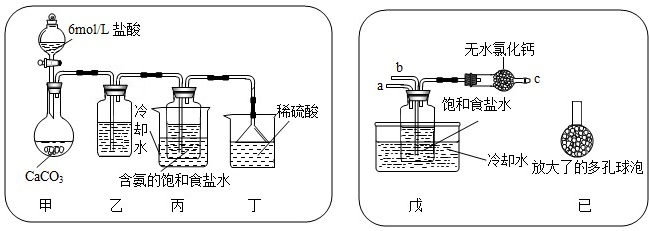
查看答案和解析>> 科目:初中化学 来源: 题型: 我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3 、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:NH3 + CO2 + H2O = NH4HCO3 ; NH4HCO3 + NaCl = NaHCO3↓+ NH4Cl ; 2NaHCO3 Na2CO3 + CO2↑+ H2O ⑴碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填标号)。 A.碳酸氢钠难溶于水 B.碳酸氢钠受热易分解 C.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出 ⑵?某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。 ① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
试回答下列有关问题: (Ⅰ)乙装置中的试剂是 ; (Ⅱ)丁装置中稀硫酸的作用是 。 (Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。 ② 另一位同学用图中戊装置(其它装置未画出)进行实验。 (Ⅰ)实验时,须先从 管通入 气体,再从 管中通入 气体。 (Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是 。 ⑶?请你再写出一种实验室制取少量碳酸氢钠的方法: 。 查看答案和解析>> 科目:初中化学 来源:2012年江苏省镇江市扬中市中考化学模拟试卷(4月份)(解析版) 题型:解答题 我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献.他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱.有关反应的化学方程式为: NH3+CO2+H2O═NH4HCO3; NH4HCO3+NaCl═NaHCO3↓+NH4Cl; 2NaHCO3  Na2CO3+CO2↑+H2O Na2CO3+CO2↑+H2O回答下列问题: (1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是______(填字母标号). a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解 c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出 (2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验. ①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出).  试回答下列有关问题: (Ⅰ)乙装置中的试剂是 饱和的碳酸氢钠溶液,作用是______; (Ⅱ)丁装置中稀硫酸的作用是______; (Ⅲ)实验结束后,分离出NaHCO3晶体的操作是______(填分离操作的名称). ②另一位同学用图中戊装置(其它装置未画出)进行实验. (Ⅰ)实验时,须先从______管通入______气体; (Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是______; (3)请你再写出一种实验室制取少量碳酸氢钠的方法:______. (4)“纯碱中常常会混有少量氯化钠.”某研究性学习小组以一包纯碱(只考虑含氯化钠)为研究对象,探究纯碱样品中碳酸钠的含量. 【实验设计】 甲方案 Ⅰ.设计思路:根据样品与氯化钙溶液反应生成沉淀碳酸钙的质量,求出碳酸钠的质量,再计算样品中碳酸钠的质量分数. Ⅱ.操作步骤:称取13.25g纯碱样品,加入过量的氯化钙溶液,充分搅拌.过滤、洗涤、干燥,得到的白色沉淀10.00g. Ⅲ.数据处理:请根据上述实验数据,计算该样品中碳酸钠的质量分数. 计算过程: ______ 乙方案 I.设计思路:根据样品(质量为a g)与稀硫酸完全反应生成二氧化碳的质量(质量为b g),求出碳酸钠的质量,再计算样品中碳酸钠的质量分数. II.实验结论: (1)当a、b的质量关系满足______(填写含a、b字母的表达式,下同)时,纯碱样品中只含有碳酸钠,样品中碳酸钠的质量分数是100%. (2)当a、b的质量关系满足______时,纯碱样品室有碳酸钠和少量氯化钠组成的混合物,样品中碳酸钠的质量分数是______. 【实验评价】 误差分析: (一)甲方案中,白色沉淀的质量在过滤、干燥等操作过程中会有所损耗,造成计算结果与实际值相比偏小.如果将氯化钙溶液换成氯化钡溶液,则可以使误差减小,理由是______. (二)乙方案中,有部分生成的二氧化碳气体因溶解于水而没有全部逸出,造成计算结果与实际值相比______(填“偏大”、“偏小”、或“不变”). 查看答案和解析>> 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |