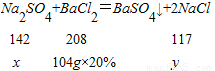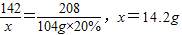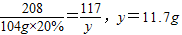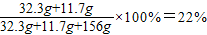在46.5g硫酸钠和氯化钠组成的混合物中,加入72.8g水,再加入104g溶质质量分数为20%的氯化钡溶液恰好完全反应,滤出沉淀(过滤时损耗不计),求:
(1)原混合物中硫酸钠的质量;
(2)反应后所得溶液中溶质的质量分数.
【答案】
分析:向硫酸钠和氯化钠组成的混合溶液中加入氯化钡溶液,硫酸钠与氯化钡发生反应生成硫酸钡沉淀和氯化钠,而混合溶液中的氯化钠不与氯化钡反应;至恰好完全反应后,所得溶液为氯化钠溶液,其溶质氯化钠由两部分组成:一部分为原混合物质中的氯化钠,另一部分则是反应生成的氯化钠;
综上所述,原混合物中的硫酸钠的质量,根据反应的化学方程式,可由生成沉淀的质量而求得;所得溶液中溶质质量分数,则是原混合物中氯化钠与生成氯化钠质量总和与所得溶液的质量比.
解答:解:设原混合物中Na
2SO
4的质量为x,生成NaCl质量为y
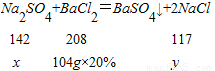
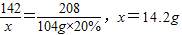
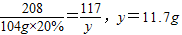
原混合物中NaCl的质量:46.5g-14.2g=32.3g
所得溶液中水的质量:72.8g+104g×(1-20%)=156g
溶液中NaCl的质量分数=
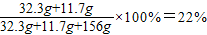
答:(1)原混合物中硫酸钠的质量14.2g;
(2)反应后所得溶液中溶质的质量分数22%.
点评:利用质量守恒定律,可以很方便地解决反应后所得溶液的问题:反应后溶液质量=固体混合物质量+溶解所加水的质量+加入氯化钡溶液的质量-生成的沉淀质量.