
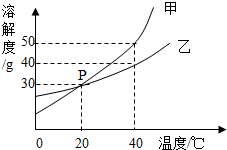
 甲、乙两种固体物质的溶解度曲线如图所示.
甲、乙两种固体物质的溶解度曲线如图所示.分析 (1)根据溶解度曲线可知,图中P点的含义是20℃甲乙物质的溶解度相同进行解答;
(2)根据40℃时甲物质的溶解度大于乙物质的溶解度以及40℃乙物质的溶解度为40g进行解答.
解答 解:(1)根据溶解度曲线可知,图中P点的含义是20℃甲乙物质的溶解度相同;故填:20℃甲乙物质的溶解度相同;
(2)40℃时甲物质的溶解度大于乙物质的溶解度,所以40℃时,饱和溶液中溶质的质量分数:甲大于乙;40℃乙物质的溶解度为40g,即在40℃100g水中最多溶解40g乙物质,所以20℃时,将50g乙物质放入100g水中,升温至40℃,溶液中溶质和溶剂的质量比为=40g:100g=2:5.故填:>;2:5.
点评 本题难度不是很大,主要考查了固体溶解度曲线的作用,根据溶解度曲线可以解决什么问题,从而加深学生对固体溶解度概念的理解,培养学生灵活的运用有关溶解度的知识的能力.


 小学课时特训系列答案
小学课时特训系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验过程 | 实验现象 |
| 实验1:分别取样于四支试管中,加入足量的水充分溶解 | ②、③完全溶解,①、④均在试管底部有白色固体,且①中有明显放热 |
| 实验2:静置一段时间后,分别取上层清液,加入试剂A | ③、④均有气泡产生 |
| 实验3:分别取样于四支试管中,加入足量试剂A | 白色固体均消失;①③④均有气泡产生 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
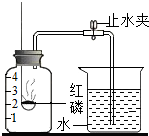 某同学设计了测定空气中氧气含量的实验,实验装置如图.该同学的实验步骤如下:
某同学设计了测定空气中氧气含量的实验,实验装置如图.该同学的实验步骤如下:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NaOH | B. | KOH | C. | 一样强 | D. | 无法比较 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com