
| A. | NaOH | B. | KOH | C. | 一样强 | D. | 无法比较 |
分析 计算等体积的10%的NaOH溶液与10%的KOH溶液中OH-数量,根据一定体积的溶液中OH-数量越多溶液碱性越强,判断10%的NaOH溶液与10%的KOH溶液碱性的强弱关系.
解答 解:假设两种溶液的体积都为vmL,
vmL10%的NaOH溶液中所含OH-数量=(vmL×1.1g/cm3×10%)×$\frac{17}{40}$×100%=0.04675v
vmL10%的KOH溶液中所含OH-数量=(vmL×1.1g/cm3×10%)×$\frac{17}{57}$×100%=0.03282v
0.04675>0.03282,所以,10%的NaOH溶液的碱性比10%的KOH溶液的碱性强;
故选:A.
点评 利用化合物中组成元素的质量分数=$\frac{相对原子质量×分子中原子个数}{相对分子质量}$×100%,把NaOH、KOH中的氢氧根看成一个整体(或一种元素),可计算其中氢氧根离子的质量分数.


科目:初中化学 来源: 题型:解答题
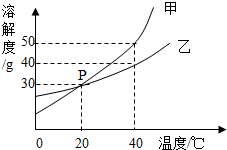 甲、乙两种固体物质的溶解度曲线如图所示.
甲、乙两种固体物质的溶解度曲线如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
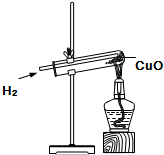 如图所示是氢气和氧化铜反应的实验装置图.请分析回答:
如图所示是氢气和氧化铜反应的实验装置图.请分析回答:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NaOH,Mg(OH)2,HCl | B. | BaCl2,AgNO3,HNO3 | ||
| C. | CaCl2,K2CO3,HCl | D. | CuSO4,NaOH,H2SO4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| OH- | CO32- | SO42- | NO3- | |
| Ba2+ | 溶 | 不 | 不 | 溶 |
| Cu2+ | 不 | 不 | 溶 | 溶 |
| Li+ | 溶 | 微溶 | 溶 | 溶 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 熟石灰、氢氧化钙、Ca(OH)2 | B. | 烧碱、碳酸钠、Na2CO3 | ||
| C. | 盐酸、氯化氢水溶液、HCl | D. | 食盐、氯化钠、NaCl |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | FeO→Fe(OH)2 | B. | CuO→Cu(OH)2 | C. | CaCO3→Ca(OH)2 | D. | BaCl2→Ba(NO3)2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
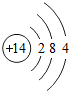 .(举一例)
.(举一例)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com