
| OH- | CO32- | SO42- | NO3- | |
| Ba2+ | 溶 | 不 | 不 | 溶 |
| Cu2+ | 不 | 不 | 溶 | 溶 |
| Li+ | 溶 | 微溶 | 溶 | 溶 |
分析 (1)根据氢氧化锂的组成分析解答;
(2)酸碱盐之间要发生复分解反应需符合复分解反应的条件,即有沉淀、气体或水生成.
解答 解:(1)氢氧化锂是由氢氧根离子与金属离子组成的,故氢氧化锂是碱;
(2)氢氧化锂与硫酸反应生成硫酸锂和水;
(3)LiOH溶液与表中离子组成的 一种盐的溶液反应,此盐与LiOH接触需要生成沉淀,此盐可为CuSO4或Cu(NO3)2,LiOH与CuSO4反应能生成Cu(OH)2沉淀和Li2SO4;LiOH与Cu(NO3)2反应能生成Cu(OH)2沉淀和LiNO3;
故答案为:(1)碱; (2)2LiOH+H2SO4═Li2SO4+2H2O;
(3)2LiOH+CuSO4═Li2SO4+Cu(OH)2↓.
点评 本题考查了复分解反应的条件以及物质间的反应,完成此题,可以依据已有的知识结合表格内容进行.了解化学性质与物理性质的差别及其应用.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
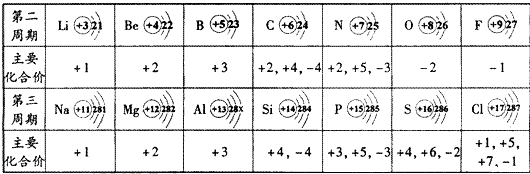
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NaOH | B. | KOH | C. | 一样强 | D. | 无法比较 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
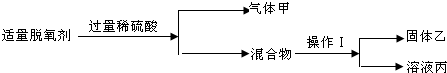
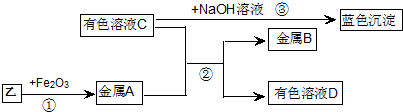
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
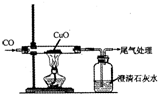 一氧化碳气体在生产生活中有着广泛的应用.请回答下列问题:
一氧化碳气体在生产生活中有着广泛的应用.请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 茶氨酸由C、H、O、N四种元素组成 | B. | 茶氨酸分子中氧的质量分数为12% | ||
| C. | 茶氨酸的相对分子质量为184 | D. | 茶氨酸中含有1个氮分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com