
【题目】稀土金属因其独特的性能而被誉为“新材料之母”。稀土金属钇的氧化物(Y2O3)广泛应用于航空航天涂层材料,其颗粒大小决定了产品的质量。利用富钇稀土(含Y2O3约70%,含Fe2O3、CuO、SiO2等约30%)生产大颗粒氧化钇的一种工艺如下:
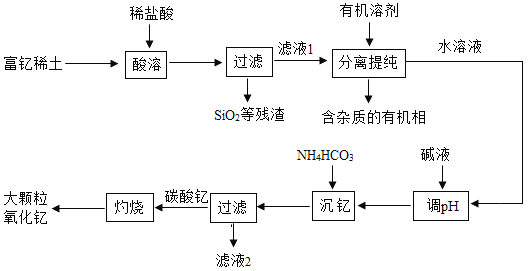
(1)“酸溶”过程中,氧化钇与盐酸反应的化学方程式是______。
(2)“分离提纯”是为了除去滤液1中的_______(填化学式)。
(3)碳酸钇灼烧分解的化学方程式是______。
(4)为了获得大颗粒氧化钇,某小组研究了条件对产品直径的影响,相关数据如表(D50表示颗粒直径):
实验编号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
沉淀反应温度/℃ | 60 | 80 | 85 | 93 | 93 | 93 |
料液浓度/(kgL) | 30 | 30 | 30 | 30 | 40 | 40 |
灼烧温度/℃ | 1100 | 1100 | 1100 | 1100 | 1100 | 1100 |
氧化钇D50/μm | 6.00 | 21.65 | 35.99 | 38.56 | 35.99 | 61.34 |
分析表中数据,其他条件不变时,若将灼烧温度均升高至1400℃ ,预期所得氧化钇D50最大的是___(填实验编号)。
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:初中化学 来源: 题型:
【题目】铝箔是现代生活中常见的包装材料。
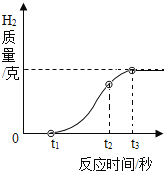
(1)用放置很久的铝箔与稀盐酸反应,产生氢气质量和反应时间关系如图所示。在0~t1时间段内,铝箔表面看不到明显气泡,原因是_______;在t2~t3时间段产生气泡的速度逐渐放缓,直到反应停止时,铝箔还有大量剩余。t2~t3时间段产生气泡速度放缓的原因_________。
(2)为进一步测量铝箔中单质铝的质量分数,现取1.9克铝箔样品与50.0克稀盐酸充分反应,铝箔完全溶解后剩余溶液的总质量为51.7克.计算样品中单质铝的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】洁厕灵、84消毒液是生活中两种常见的清洁、消毒用品,混合使用时会发生如图所示的化学反应。下列说法正确的是
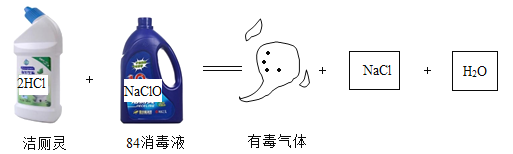
A.生成的有毒气体是Cl2B.该反应属于化合反应
C.反应前后元素的化合价不变D.洁厕灵、84消毒液可混合使用
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列四个图象能正确反映其对应实验操作的是
A. 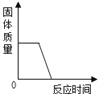 高温煅烧一定质量的石灰石
高温煅烧一定质量的石灰石
B.  用等质量、等浓度的双氧水分别制取氧气
用等质量、等浓度的双氧水分别制取氧气
C.  向一定体积的水中逐滴加入氢氧化钠溶液
向一定体积的水中逐滴加入氢氧化钠溶液
D.  某温度下,向一定量不饱和硝酸钾溶液中加入硝酸钾晶体
某温度下,向一定量不饱和硝酸钾溶液中加入硝酸钾晶体
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】KNO3 的溶解度曲线如下图所示。下列说法错误的是( )
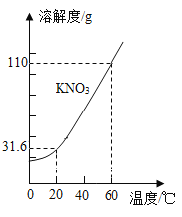
A.0~60℃,KNO3 的溶解度随温度升高而增大
B.60℃时的 KNO3 饱和溶液降温至 20℃,有晶体析出
C.20℃,100g 水中最多能溶解 31.6g KNO3
D.60℃时,可配制溶质质量分数为 60%的 KNO3 溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙是初中化学常见的三种物质,其相互转化关系如图,通常甲为固态单质,乙、丙为常温下的两种常见气体,且所含元素种类相同,乙易与血液中的血红蛋白结合。下列说法正确的是( )
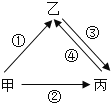
A.①②两个转化的反应中,只能验证甲具有可燃性
B.干燥的丙能使紫色石蕊变成红色
C.③的转化可通过和金属氧化物反应来实现
D.乙和丙均由分子构成,且都易溶于水
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2019年诺贝尔化学奖三位得主研制出锂离子电池,目前被广泛应用于便携电子设备和新能源汽车。如图是锂元素的原子结构示意图及其在周期表中的相关信息。
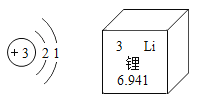
(1)锂元素位于元素周期表中第___周期,在化学反应中容易____(填“得到”或“失去”)最外层电子,所形成的离子符号为______。
(2)研究表明,锂的金属活动性比较活泼。锂与稀硫酸反应的化学方程式为______,该反应的基本类型为________。
(3)氢氧化锂与氢氧化钠的化学性质相似,氢氧化锂与二氧化碳反应的化学方程式为____,在航天舱内如果要吸收航天员呼出的二氧化碳气体,用氢氧化锂比氢氧化钠更理想,分析其原因是_____。
(4)如今锂离子电池是我们生活中必备的能量源。锂离子电池具有的一个优点是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】中和反应是一类重要的化学反应。某同学利用图1装置研究稀硫酸与氢氧化钠溶液反应的过程,并用pH传感器和温度传感器测量反应过程中相关的变化情况,得到图2和图3。
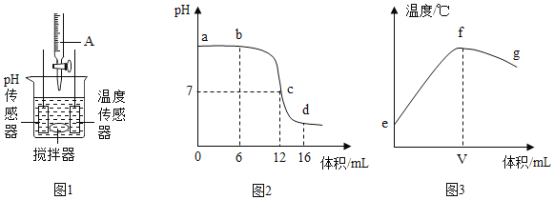
(1)烧杯中发生反应的化学方程式为______。
(2)仪器A中溶液的溶质是_____(填化学式)。
(3)图3中V的数值最接近_____(填“6”、“12”或“16”)。
(4)下列说法错误的是_____。
A.图2中b点所示溶液中的溶质是Na2SO4和NaOH
B.图2中d点所示溶液中所含微粒有Na+、SO42-、H+、H2O
C.图2中c→d所示溶液中Na2SO4的质量不断增加
D.图3中e→f变化趋势可说明该反应是放热反应
(5)本实验中需要准备溶质质量分数为9.8%的稀硫酸250g,若用98%的浓硫酸来配制,需要浓硫酸____克,需加水_____mL(水的密度为1g/mL)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某锥形瓶盛有盐酸和氯化铜的混合溶液100g,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量与滴人的氢氧化钠溶液质量的变化关系如图所示。请计算:
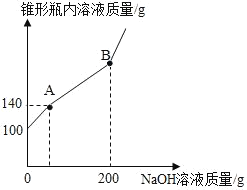
(1)配制质量分数为10%的氢氧化钠溶液200g,需要氢氧化钠的质量是_____g。
(2)计算溶液中氯化铜的质量。_____(写出相应的计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com