
| A. | 分离空气得到的氮气常用作保护气 | |
| B. | 空气中的氧气约占空气总体积的五分之四 | |
| C. | 空气中的稀有气体不与任何物质发生反应 | |
| D. | 二氧化碳是造成酸雨的主要物质 |
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
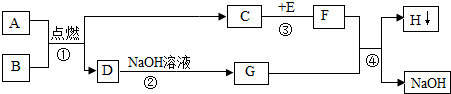
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
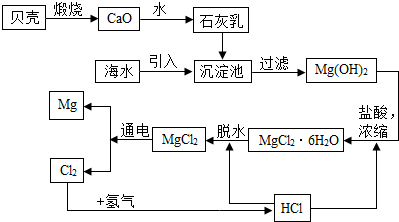
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
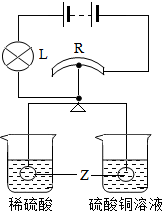 如图所示,R是滑动变阻器,它的金属滑片垂直固定在等臂金属杠杆的中央且可以随杠杆左右移动.杠杆两端分别悬挂等质量、等体积的金属锌球,此时杠杆平衡.再将锌球同时分别浸没到密度相同的稀硫酸和硫酸铜溶液中.反应一段时间后会观察到:
如图所示,R是滑动变阻器,它的金属滑片垂直固定在等臂金属杠杆的中央且可以随杠杆左右移动.杠杆两端分别悬挂等质量、等体积的金属锌球,此时杠杆平衡.再将锌球同时分别浸没到密度相同的稀硫酸和硫酸铜溶液中.反应一段时间后会观察到:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
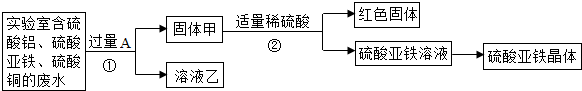

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com