
【题目】下列说法正确的是( )
A. 根据质量守恒定律,1g氢气和1g氧气反应生成2g水
B. 3g的碳完全燃烧后,生成了11g二氧化碳,则消耗空气8g
C. 只有固体、液体间反应遵守质量守恒定律,如果有气体参加反应,就不遵守质量守恒定律
D. 铜粉在空气中加热,反应后固体的质量增加
科目:初中化学 来源: 题型:
【题目】对销售的化肥,国家有明确的质量要求。某兴趣小组对市售的某钾肥进行了检测,称取2.0g样品放入烧杯中,加入适量的水溶解后,逐滴加入10%的BaCl2溶液,产生沉淀的质量与所加入BaCl2溶液质量的关系如图1所示(假定杂质不参加反应)。
已知:K2SO4+BaCl2═BaSO4↓+2KC1。

(1)20.8g BaCl2溶被中所含溶质的质量为_____g。
(2)通过计算,判断该钾肥中K2SO4的质量分数是否符合图2的包装说明________?(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】t℃时,取四个各盛有50g水的烧杯,分别加入甲、乙、丙、丁四种物质各20g,充分溶解,其溶解情况如图所示。下列说法正确的是( )
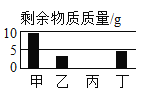
A. t℃时四种溶液都是饱和溶液
B. 甲溶液的溶质质量分数最大
C. t℃时四种物质溶解度最大的是丙
D. 升高温度乙物质一定能继续溶解
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】20℃时,KCl 的溶解度为 34.0g。向下列 4 只盛有 100g 水的烧杯中,分别加入不同质量的 KCl 固体,充分溶解。下列说法不正确的是
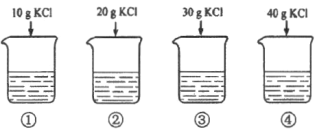
A. 上述溶液为不饱和溶液的是①②③B. 有固体残留的烧杯是③④
C. ②溶液中溶质的质量分数为 16.7%D. ①溶液中再加入 24.0g 固体恰好饱和
查看答案和解析>>
科目:初中化学 来源: 题型:
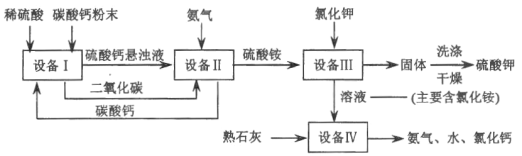
【题目】某化工厂用废硫酸制备硫酸钾的流程如下,请回答下列问题:
资料:己知20℃时硫酸铵、硫酸钾溶解度如下表:
物质 | 硫酸钾 | 氯化钾 | 氯化铵 | 硫酸铵 |
溶解度/g(20℃) | 11.1 | 34.2 | 37.2 | 75.4 |
(1)“设备I”中将碳酸钙研成粉末的目的是_____。
(2)“设备II”中发生的化学反应方程式是_____。
(3)“设备III”中发生的化学反应方程式是_____。反应物之一硫酸铵[(NH4)2SO4)]中氮元素的化合价为_____。洗涤从“设备III”中得到的固体时,不用水而是用饱和硫酸钾溶液,其目的是_____。
(4)上述流程中可循环使用的物质除水外,还有_____(填写化学式).
(5)根据本题所给的信息推断实验室_____(能、不能)用碳酸钙粉末和稀硫酸反应制备得到二氧化碳。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在用白磷(白磷与红磷组成相同,着火点为40℃)探究质量守恒定律的实验中,晓涵同学将橡皮塞上的细玻璃管下端放到酒精灯火焰上灼烧至红热后,迅速用橡皮塞将锥形瓶塞紧,并引燃白磷,实验过程如下图所示。请回答下列问题:
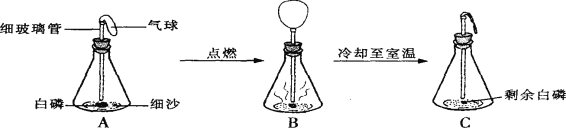
(1)实验观察到A、C中气球的大小不同,产生此现象的原因是 __________________;B气球胀大的原因是:_______________________。
(2)装置:锥形瓶的底部铺有一层细沙,其作用是 ________________;气球的作用是:_______。
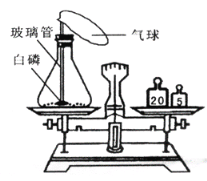
(3)白磷燃烧:白磷燃烧过程中看到的现象是 ________ 。
(4)反思:白磷燃烧 _____(填“遵守”或“不遵守”)质量守恒定律,理由是 ______________ ;该反应的方程式:______________,该反应的基本类型为_____________,
(5)燃烧前称量,锥形瓶的总质量为29.6g,则右图托盘天平中游码的读数为________g.
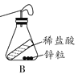
(6)某同学用 图B 所示的装置测定质量守恒定律,将锌粒和稀盐酸混合后称量:发现托盘天平指针偏向右边,造成的原因可能是 _____________(只写一条)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请用正确的化学用语填空:
(1)氖元素_____;(2)3个氮原子________;(3)四个氧化铝分子_________;
(4)三个亚铁离子________________;(5)硝酸根离子___________;
(6)氧化钙中钙元素的化合价____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂。下图是工业上用印刷电路的蚀刻液的废液(含FeCl3、CuCl2、FeCl2)生产CuCl的流程并制得FeCl3蚀刻液。
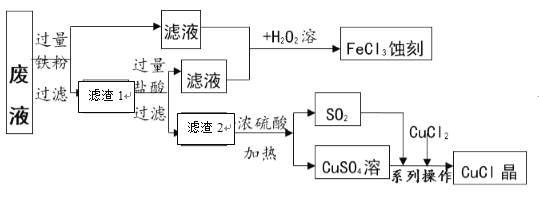
[资料] (1)氯化亚铜是一种白色晶体,微溶于水、不溶于乙醇及稀硫酸;
(2)2FeCl3+Fe = 3FeCl2按要求回答下列问题:
(1)废液中加入铁粉时,发生置换反应的化学方程式为____________;滤渣2的成分是_____________。
(2)滤液1、2合并后与过氧化氢溶液反应的化学方程式为___________________。
(3)上述流程中生成CuCl的化学方程式为:SO2 + CuSO4 + CuCl2+ 2H2O ===2CuCl↓+2X,则X的化学式为____________。分离、提纯CuCl晶体过程中的“系列操作”包括“调pH、过滤、洗涤、低温烘干”。为得到纯净的CuCl晶体,可用下列____________ (填字母序号)进行洗涤。
a.纯净水 b.乙醇 c.稀硫酸 d.氯化铜溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氢氧化镁是一种重要的化工原料,某矿石由MgO、Fe2O3、CuO和SiO2组成,用它制备氢氧化镁的流程示意图如图:
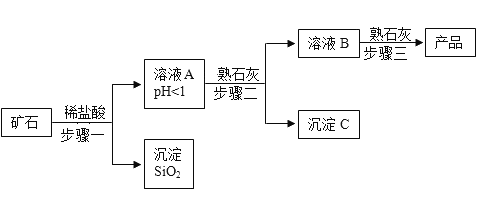
(注:在步骤二中,通过控制加入熟石灰的量,可使不同的金属离子先后生成沉淀)
(1)请写出步骤一中发生反应的化学方程式:_____(任写一个);
(2)溶液A中所含的非金属阳离子有_____(填离子符号);
(3)沉淀C的成分_____
(4)三个步骤中均用到的玻璃仪器是_____、_____、_____;
(5)步骤三中生成产品的化学方程式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com