
分析 根据二氧化碳中C的质量分数和二氧化碳的质量,即可算出二氧化碳中含有碳的质量;同理根据水中H的质量分数和水的质量,即可计算出水中含有氢的质量;根据质量守恒定律,即可计算出该物质中含有氧的质量,据此判断、计算.
解答 解:先根据反应前后元素的种类不变,确定:该物质中一定含有碳、氢两种元素,可能含有氧元素.再根据反应前后元素的质量相等,来确定氧元素是否含有.
二氧化碳中碳的质量为:4.4g×$\frac{12}{44}$×100%=1.2g;
水中氢的质量为:2.7g×$\frac{2}{18}$×100%=0.3g;
碳元素与氢元素质量之和为1.2g+0.3g=1.5g;
由于1.5g<2.3g,所以该物质中一定含有氧元素,且含有氧的质量为2.3g-1.5g=0.8g.
故可判断该化合物中一定含有C、H、O元素,质量比为:1.2g:0.3g:0.8g=12:3:8.
C原子个数:H原子个数:O原子个数:$\frac{12}{12}$:$\frac{3}{1}$:$\frac{8}{16}$=2:6:1;
故答案为:(1)C:H:O=12:3:8
(2)C原子个数:H原子个数:O原子个数=2:6:1
点评 本题主要考查学生运用质量守恒定律和化学式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.


科目:初中化学 来源: 题型:选择题
| A | B | C | D | |
| pH | 肥皂水(9~10) | 饮用水(6~7) | 柠檬汁(2~3) | 洁厕灵(1~2) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
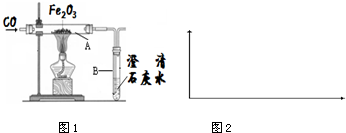
| 操作步骤 | 实验现象 | 解释或反应方程式 |
| 1.取少量黑色物质加入 30%热的盐酸中 | 无气泡、溶液颜 色变成黄绿色 | 该反应的化学方程式:Fe3O4+8HCl═FeCl2+2FeCl3+4H2O |
| 2.用磁铁吸引此粉末 | 能够被吸引 | 说明该物质具有磁性 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 方法 | 实验步骤依次编号 | 方程式 |
| 例: | A、B、H、G | Fe2O3+3H2SO4═Fe2(SO4)3+3H2O |
| 方法一 | ||
| 方法二 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | KOH、Na2CO3、HCl | B. | BaCl2、NaCl、H2SO4 | ||
| C. | Ca(OH)2、KNO3、Na2CO3 | D. | Ba(OH)2、NaOH、HNO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 钠原子得到电子变成阳离子 | |
| B. | 氯气中氯元素的化合价为-1价 | |
| C. | 反应前后钠元素总质量不变 | |
| D. | 氯化钠由氯元素和钠元素组成,所以是混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com