

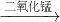 水+氧气,该反应的反应物是一种,生成物是两种,属于分解反应.
水+氧气,该反应的反应物是一种,生成物是两种,属于分解反应.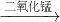 水+氧气;分解;
水+氧气;分解;

 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:初中化学 来源: 题型:
| 二氧化锰 |
| 二氧化锰 |
查看答案和解析>>
科目:初中化学 来源: 题型:
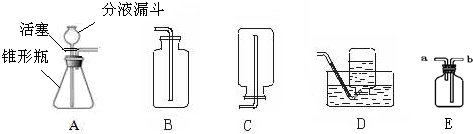
 过氧化氢溶液在二氧化锰作催化剂的条件下能迅速分解成氧气和水.分液漏斗可以通过调节活塞控制液体滴加速度.回答下列问题
过氧化氢溶液在二氧化锰作催化剂的条件下能迅速分解成氧气和水.分液漏斗可以通过调节活塞控制液体滴加速度.回答下列问题查看答案和解析>>
科目:初中化学 来源: 题型:
| 二氧化锰 |
| 二氧化锰 |
查看答案和解析>>
科目:初中化学 来源: 题型:

| 二氧化锰 |
| 二氧化锰 |
查看答案和解析>>
科目:初中化学 来源: 题型:

| MnO2 |
| MnO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com