某同学在参加学校开展的综合实践活动中,考察了学校附近一家化工厂在“零点行动”前后的污水处理情况(“零点行动”是国家保护太湖流域水资源所采取的专项行动).该同学在考察过程中收集到了如下资料:①该化工厂排放的污水中主要成分是盐酸、提取未处理的污水水样,用pH试纸测得pH=3;
②处理污水步骤之一是:污水进入中和池进行中和处理,所用的材料是较经济的石灰水.
③提取经过处理后可以排放的水样,测得pH在7左右.
根据上述提供的资料,回答下列问题:
(1)该同学的这种考察属于______调查(填直接或间接)
(2)要测出污水的酸碱度,若不用pH试纸,可选用下列______方法
A.酚酞指示剂检验 B.中和滴定 C.紫色石蕊试液检验
(3)经计算得知pH=3的污水中,盐酸的质量分数为0.00365%,现假设中和池中有1.0×106kg污水(污水中其他物质均不与氢氧化钙反应),至少需要多少千克氢氧化钙才能完全中和?
【答案】
分析:本题需利用酸碱中和反应降低废水的酸性.污水中的主要成分是盐酸,用石灰水进行中和处理,生成氯化钙和水,从而减低污染.
(1)不是直接得到结果,而是利用化学方法得到.
(2)测出污水的酸碱度,有固定的值,A和C都只能粗略估计,而中和滴定可以得出较准确的值.
(3)利用酸碱中和的反应可以计算得到.
解答:解:(1)根据题意可知先搜集资料,借助化学的方法来进行考察,故答案为:间接.
(2)因要测出污水的酸碱度,选项中只有中和滴定可以测到较准确的值,故选B.
(3)设完全中和需要氢氧化钙的质量为x,则
Ca(OH)
2+2HCl═CaCl
2+2H
2O
74 2×36.5
x 1.0×10
6kg×0.00365%
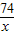
═
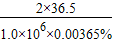
解得:x═37kg
答:需要37千克氢氧化钙才能完全中和.
点评:利用化学反应来处理实际问题,使化学为人类的生活和生产服务.能用中和的化学反应进行相关的化学方程式的计算.

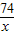 ═
═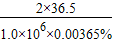


 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案