
【题目】取10锌粉和铜粉的混合物于烧杯中,向烧杯中分四次加入等质量的同种稀硫酸,实验过程中得到如下数据.
第1次 | 第2次 | 第3次 | 第4次 | |
加入稀硫酸的质量 | 20g | 20g | 20g | 20g |
剩余固体的质量 | 8.7g | 7.4g | 6.1g | 5.5g |
(1)混合物中铜粉的质量分数是多少?
(2)计算所用稀硫酸中溶质的质量分数.(保留计算过程)
【答案】
(1)解:由图表可知,每次加入的稀硫酸的质量相等,第1次加入20g稀硫酸固体减少了10g﹣8.7g=1.3g,说明20g稀硫酸恰好与1.3g锌反应,第4次加入20g稀硫酸固体减少了6.1g﹣5.5g=0.6g,说明混合物中的锌已反应完,剩余固体的质量就是混合物中铜的质量,所以混合物中铜的质量分数为: ![]() ×100%=55%
×100%=55%
(2)解:第1次加入20g稀硫酸固体减少了0g﹣8.7g=1.3g,说明20g稀硫酸恰好与1.3g锌反应;
设第1次参加反应的硫酸的质量为x
Zn+ | H2SO4═ZnSO4+H2↑ |
65 | 98 |
1.3g | x |
![]() =
= ![]()
x=1.96g
稀硫酸中溶质的质量分数为: ![]() ×100%=9.8%
×100%=9.8%
【解析】(1)因为铜不与硫酸反应,混合物中只有锌与硫酸反应,由图表可知,每次加入的稀硫酸的质量相等,第1次加入20g稀硫酸固体减少了10g﹣8.7g=1.3g,说明20g稀硫酸恰好与1.3g锌反应,第4次加入20g稀硫酸固体减少了6.1g﹣5.5g=0.6g,说明混合物中的锌已反应完,剩余固体的质量就是混合物中铜的质量,然后计算铜的质量分数;(2)由于所加的是同种稀硫酸,第1次稀硫酸完全参加反应,可据第1次反应的锌的质量结合方程式计算参加反应的硫酸的质量,结合溶质的质量分数计算解答.
【考点精析】利用根据化学反应方程式的计算对题目进行判断即可得到答案,需要熟知各物质间质量比=系数×相对分子质量之比.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
【题目】如图表示CO2的循环过程,其中物质X能为人体直接提供能量,下列说法错误的是( ) 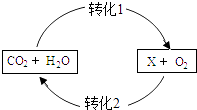
A.X中C,H,O的原子个数之比为1:2:1
B.转化1是自然界中将无机物转化为有机物的主要途径
C.X在人体中氧化产生的CO2如不及时排出,则血液的pH将增大
D.人呼出的气体和吸入的空气的成分相比,CO2和H2O的含量增加
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有六种物质①二氧化碳、②熟石灰、③盐酸、④碳酸氢钠、⑤氯化钠、⑥苛性钠。请选择合适物质的序号填空:
(1)可用于治疗胃酸过多症的是。
(2)农业上常用来降低土壤酸性的是。
(3)厨房常用的调味品的主要成分是。
(4)能用来灭火的是。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种固体物质的溶解度曲线如图1所示,请根据曲线图回答下列问题. 
(1)气体的溶解度随温度的变化规律与(填“甲”或“乙”)相似.
(2)小明同学用甲物质进行以下实验(如图2):
①实验过程中,所得溶液溶质质量分数相同的是(填字母序号).
②若甲在溶于水时会有热量放出,在向B中溶液再加入30g甲固体的过程中,除了感受到温度的变化,还会看到的现象是 .
③现利用溶液E配制100g10%的甲溶液,需用到的仪器有:烧杯、
A.托盘天平(带砝码盒) B.药匙 C.玻璃棒 D.漏斗 E.铁架台 F.量筒
G.胶头滴管.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】分类、类推是学习化学的重要方法. 
(1)请根据图标的作用.自拟分类标准,将下列常见的标志平均分为两类:
所选取的三个标志是(填序号) , 你的分类标准为 .
(2)小冰翻阅姐姐的高一教材,对教材中这个规律产生了兴趣:“同温同压下,粒子数相同的任何气体都有相同的体积”.也就是说,相同条件下的气体体积比等于分子个数比.联想电解水的实验,明白了为什么产生氢气体积是氧气体积的二倍.请你类推,空气的成分中,氮气和氧气的分子个数比约为 , 如果完全燃烧42体积的氢气,至少需要体积的空气.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com