

| 36.5 |
| 58.5 |
| 14.6g |
| X |
| 23.4g |
| 73g+127g |


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
| A、是无色溶液 | B、是稀溶液 |
| C、是饱和溶液 | D、是浓溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
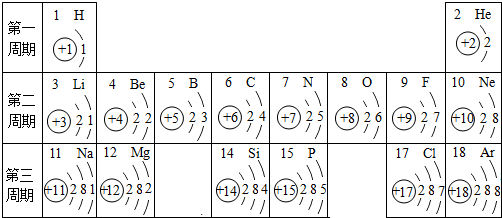
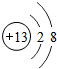 表示的是
表示的是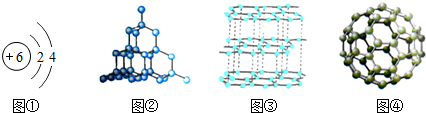
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 某补钙剂说明书的部分信息如图所示.小明对该补钙剂十分感兴趣,取10片钙片放入100g稀盐酸中,有效成分刚好完全反应(其他成分不与盐酸反应).剩余固体和液体总质量比反应前减少了2.2g.请完成下列问题:
某补钙剂说明书的部分信息如图所示.小明对该补钙剂十分感兴趣,取10片钙片放入100g稀盐酸中,有效成分刚好完全反应(其他成分不与盐酸反应).剩余固体和液体总质量比反应前减少了2.2g.请完成下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com