
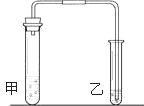
 研究性学习小组对碳酸钠和碳酸氢钠的性质进行探究,请你参与实验.
研究性学习小组对碳酸钠和碳酸氢钠的性质进行探究,请你参与实验.| 碳酸钠+盐酸 | 碳酸氢钠+盐酸 | |
| 实验现象 | ||
| 化学反应方程式 |
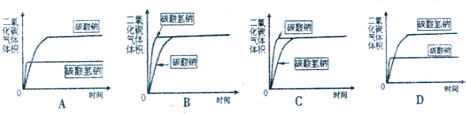
温度 溶解度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
有大量无色气泡放出,该气体能使澄清石灰水变浑 | 更迅速地放出大量无色气泡,该气体能使澄清石灰水变浑 |
| Na2CO3+2HCl=2NaCl+H2O+CO2↑ | NaHCO3+HCl=NaCl+H2O+CO2↑ |
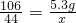 x=2.2g
x=2.2g 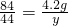 y=2.2g
y=2.2g 

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:初中化学 来源: 题型:阅读理解
 23、某研究性学习小组对“SO2能否与H2O反应生成酸”进行探究.请你参与他们的探究活动,并回答有关问题.
23、某研究性学习小组对“SO2能否与H2O反应生成酸”进行探究.请你参与他们的探究活动,并回答有关问题.
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 17、17、研究性学习小组对碳酸钠和碳酸氢钠的性质进行探究,请你参与实验.
17、17、研究性学习小组对碳酸钠和碳酸氢钠的性质进行探究,请你参与实验.
查看答案和解析>>
科目:初中化学 来源: 题型:
 某校研究性学习小组对福州某段内河水质的状况进行相关的调查研究.
某校研究性学习小组对福州某段内河水质的状况进行相关的调查研究.查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| ||
| ||

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com