


 CO2、CO2+C
CO2、CO2+C 2CO、3CO+Fe2O3
2CO、3CO+Fe2O3 2Fe+3CO2;冶炼得到的生铁是铁的合金,属混合物,里面混有少量的杂质.
2Fe+3CO2;冶炼得到的生铁是铁的合金,属混合物,里面混有少量的杂质.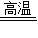 CO2、CO2+C
CO2、CO2+C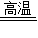 2CO、3CO+Fe2O3
2CO、3CO+Fe2O3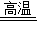 2Fe+3CO2;冶炼得到的生铁;当向生铁中加入过量稀盐酸时,铁完全反应产生气泡溶液变成浅绿,反应完全后有黑色不溶物,即里面混有少量的杂质(炭等).故答案为:3CO+Fe2O3
2Fe+3CO2;冶炼得到的生铁;当向生铁中加入过量稀盐酸时,铁完全反应产生气泡溶液变成浅绿,反应完全后有黑色不溶物,即里面混有少量的杂质(炭等).故答案为:3CO+Fe2O3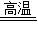 2Fe+3CO2;生铁逐渐溶解,有气泡产生,溶液变成浅绿,反应完全后烧杯底部有黑色不溶物.
2Fe+3CO2;生铁逐渐溶解,有气泡产生,溶液变成浅绿,反应完全后烧杯底部有黑色不溶物.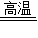 2Fe+3CO2;生铁逐渐溶解,有气泡产生,溶液变成浅绿,反应完全后烧杯底部有黑色不溶物.
2Fe+3CO2;生铁逐渐溶解,有气泡产生,溶液变成浅绿,反应完全后烧杯底部有黑色不溶物.

科目:初中化学 来源: 题型:



查看答案和解析>>
科目:初中化学 来源: 题型:



查看答案和解析>>
科目:初中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
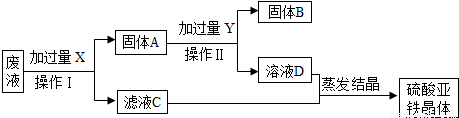
 铝、铁、铜是我们生活中常见的金属.
铝、铁、铜是我们生活中常见的金属.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com