
【题目】甲、乙两物质的溶解度曲线如图所示。下列叙述中,正确的是( )
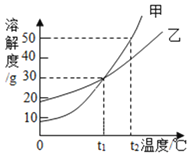
A. 甲溶解度一定大于乙溶解度
B. ![]() 时,甲和乙的饱和溶液中溶质质量分数相等
时,甲和乙的饱和溶液中溶质质量分数相等
C. ![]() 时,在100g水中放入60g甲,其溶质的质量分数为
时,在100g水中放入60g甲,其溶质的质量分数为![]()
D. ![]() 时,分别在100g水中各溶解20g甲、乙,同时降低温度,甲先达到饱和
时,分别在100g水中各溶解20g甲、乙,同时降低温度,甲先达到饱和
科目:初中化学 来源: 题型:
【题目】阅读下面科普短文。
说起二氧化硫(SO2),你可能首先想到它是空气质量播报中提及的大气污染物。其实你真的了解SO2吗?难道它只是有害物质吗?
SO2与食品工业
SO2作为防腐剂、漂白剂和抗氧化剂广泛用于食品行业。葡萄酒酿制中适量添加SO2,可防止葡萄酒在陈酿和贮藏过程中被氧化,抑制葡萄汁中微生物的活动。食糖加工过程中可使用SO2进行脱色。按照我国《食品添加剂使用标准(GB2760-2014)》,合理使用SO2不会对人体健康造成危害。
标准中部分食品SO2的最大残留量
食品 | 蜜饯 | 葡萄酒 | 食糖 | 水果干 | 巧克力 | 果蔬汁 |
最大残留量 | 0.35g/kg | 0.25g/L | 0.1g/kg | 0.1g/kg | 0.1g/kg | 0.05g/kg |
SO2与硫酸工业
硫酸是重要的化工原料,工业制硫酸的关键步骤是SO2的获取和转化。工业利用硫制硫酸的主要过程示意如下:
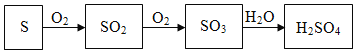
硫酸工业的尾气中含有少量SO2,若直接排放会污染空气,并导致硫酸型酸雨。工业上可先用氨水吸收,再用硫酸处理,将重新生成的SO2循环利用。
SO2与化石燃料
化石燃料中的煤通常含有硫元素,直接燃烧会产生SO2。为了减少煤燃烧产生的SO2污染空气,可以采取“提高燃煤质量,改进燃烧技术”的措施,例如,对燃煤进行脱硫、固硫处理;还可以采取“优化能源结构、减少燃煤使用”的措施,例如,北京大力推广的“煤改气、煤改电”工程,有效改善了空气质量。
现在,你对SO2一定有了新的认识,在今后的化学学习中你对SO2还会有更全面的认识!
依据文章内容回答下列问题。
(1)按照国家标准,食糖中的SO2最大残留量为 g/kg。
(2)葡萄酒酿制过程中SO2的作用是 。
(3)用硫制硫酸的主要过程中,涉及到的含硫物质有S、 和H2SO4。
(4)硫酸工业生产中,吸收尾气中SO2的物质是 。
(5)下列措施能减少SO2排放的是 (填序号)。
A.将煤块粉碎 B.对燃煤进行脱硫
C.推广煤改气、煤改电 D.循环利用工业尾气中的SO2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙、丁是初中化学常见的四种物质。已知乙是红棕色固体,丙是熟石灰,甲、丁是同类物质,丁由两种元素组成且其浓溶液敞口放置在空气中,瓶口会形成白雾。其相互反应及转化关系如图所示,“一”表示相连的两种物质能发生反应,“→”表示一种物质能转化成另一种物质,部分反应物、生成物及反应条件未标出。
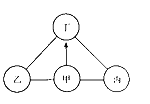
(1)甲的化学式为_____。
(2)甲转化为丁需要加入的物质是_____(写化学式),丁与丙反应的化学方程式为_____,该反应的基本反应类型是_____。
(3)乙物质转化为其单质的化学方程式为_____。
(4)请列举甲物质的一项用途_____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请根据下列实验装置图回答问题。
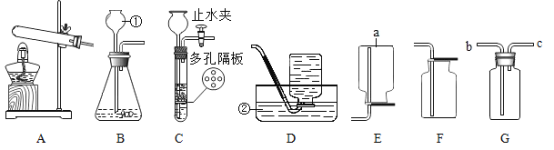
(1)写出标号仪器的名称:①_____。
(2)实验室加热KMnO4制O2时,应选用的气体发生和收集装置组合为_____(填装置序号)。反应的化学方程式为_____。
(3)有一名同学欲用G装置收集CO2,则气体应该从导气管口_____端通入。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A~G是七种初中常见的化学物质,其中 A、B、C、D、E分别是五种不同类别(即单质、氧化物、酸、碱、盐)的物质,D和F由两种相同的元素组成,E的粉末为黑色(其中“→”表示一种物质可以通过一步反应转化为另一种物质,部分反应物、生成物、反应条件已省略)。请写出:
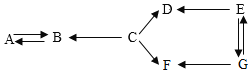
(1)F的化学式_____。
(2)B→A反应的化学方程式为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为实现废物“资源化”利用的目的,以电石渣[主要成份为Ca(OH)2和CaCO3.其中Ca(OH)2为微溶物]为原料制备KClO3,其主要流程如图所示:

(1)氯化过程中,Cl2与Ca(OH)2作用,发生了一系列变化,最终生成Ca(ClO3)2和CaCl2,该反应的化学方程式中这两种生成物的化学计量数比为1:5
①生成Ca(CIO3)2的化学方程式______。
②提高Cl2转化为Ca(ClO2)2的转化率的可行措施有______(填标号)。
A 适当减缓通入Cl2速率 B 充分搅拌浆料 C 加水使Ca(OH)2完全溶解
(2)活性炭的作用是______;步骤甲的操作名称为______;残渣A中一定含有______。
(3)向步骤I得到的溶液中加入稍过量KCl固体可将Ca(ClO2)2转化为KClO3,该反应的基本反应类型为______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用化学用语填空。
(1)3个氩原子___。
(2)四氧化三铁___。
(3)4个二氧化硅分子___。
(4)汞元素___。
(5)标出SO3中硫元素的化合价___。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列为四种粒子的结构示意图,其中说法不正确的是
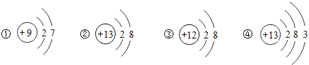
A. 它们表示四种元素
B. ④表示的元素在化合物中通常显+3价
C. ①表示的粒子在化学反应中易得到电子
D. ②③都表示阳离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com