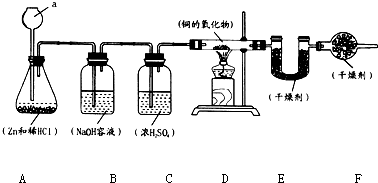
实验室用锌和稀盐酸制取氢气,并用氢气还原铜的一种氧化物的实验来测定该氧化物的组成.实验装置如图所示:
试回答下列问题:
(1)仪器a的名称是
长颈漏斗
长颈漏斗
,a仪器下端管口插入液面下的目的是
防止生成的氢气从长颈漏斗口逸出
防止生成的氢气从长颈漏斗口逸出
.
(2)B、C、F装置的作用分别是:B
除去氢气中的氯化氢气体
除去氢气中的氯化氢气体
,C
除去氢气中的水蒸气
除去氢气中的水蒸气
,F
吸收空气中的水蒸气,防止进入E装置
吸收空气中的水蒸气,防止进入E装置
.
(3)在点燃D装置中酒精灯以前,要将氢气通过整个装置一段时间的目的是
排除整个装置内的空气,防止加热时发生爆炸
排除整个装置内的空气,防止加热时发生爆炸
.
(4)A中产生的现象是
产生大量气泡,锌粒逐渐溶解
产生大量气泡,锌粒逐渐溶解
,反应的化学方程式是
Zn+2HCl=ZnCl2+H2↑
Zn+2HCl=ZnCl2+H2↑
.
(5)已知D装置中铜的氧化物的质量为7.2g,当其完全被还原时,称得E装置增重0.9g,则这种铜的氧化物中铜元素和氧元素的质量比的原始计算式为
,其化学式为
Cu2O
Cu2O
.
(6)如果B、C装置的顺序颠倒,将造成铜、氧两元素的质量之偏
低
低
(填“高”或“低”),原因是
B装置中的水蒸气会随气流进入E装置,使测出水的质量增加,从而导致由水计算出的氧元素的质量增大,铜元素质量减少,最终导致结果偏低
B装置中的水蒸气会随气流进入E装置,使测出水的质量增加,从而导致由水计算出的氧元素的质量增大,铜元素质量减少,最终导致结果偏低
.

 实验室用锌和稀盐酸制取氢气,并用氢气还原铜的一种氧化物的实验来测定该氧化物的组成.实验装置如图所示:
实验室用锌和稀盐酸制取氢气,并用氢气还原铜的一种氧化物的实验来测定该氧化物的组成.实验装置如图所示:


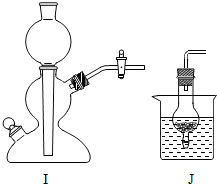
 右图所示为某同学在实验室用锌和稀盐酸制取并临时存放氢气.请根据要求回答问题:
右图所示为某同学在实验室用锌和稀盐酸制取并临时存放氢气.请根据要求回答问题:
