
【题目】保护环境,减少污染,让美丽的泉城以全新的面貌迎接全运会,是每个泉城人的义务。下列做法中,不利于改善城市环境的是:
A. 严禁就地焚烧作物秸秆 B. 发展沿街露天烧烤 C. 植树种花防风固沙 D. 综合治理城市污水
科目:初中化学 来源: 题型:
【题目】一化工厂产生的废液中含有硫酸亚铁和硫酸铜(不考虑其他物质),为回收铜和硫酸亚铁,研究人员设计出“用铁处理”的方案。取100 g上述废液,向其中加入2.8 g铁粉,恰好完全反应,测得反应后溶液中溶质的质量分数为15%。求:
(1)回收得到铜的质量为________g。
(2)回收得到硫酸亚铁的质量是多少?(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据化学方程式不能获得的信息是( )
A.反应中的反应物和生成物
B.各反应物、生成物之间的质量比
C.化学反应速率的快慢程度
D.反应发生所需要的条件
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】分析处理图表的信息是学习化学的一种重要方法。下表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
温度/℃ | 10 | 20 | 30 | 40 | |
溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 |
碳酸钠 | 12.2 | 21.8 | 39.7 | 53.2 | |
(1)40 ℃时,氯化钠的溶解度为________g。
(2)碳酸钠的溶解度随温度的升高而________(填“增大”或“减小”)。在20 ℃时,在100 g的水中加入30 g碳酸钠,充分搅拌后得到的是________(填“饱和溶液”或“不饱和溶液”),将上述溶液升温到30 ℃,该溶液的溶质质量分数为________(计算结果精确到0.1%)。
(3)10 ℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的物质是________________________________________________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】偏钛酸钡(BaTiO3)因其显著地“压电效应”而光广泛的应用于超声波发射装置中,已知偏钛酸钡中Ba元素的化合价为+2价,则其中钛元素(Ti)的化合价为( )
A.+1 B.+2 C.+3 D.+4
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙、丙三种固体物质的溶解度曲线,请根据溶解度曲线回答下列问题:

(1)交点P表示的含义是______________;
(2)t 3℃ 时,将 30g 甲物质加入到 50g 水中,充分溶解后所得溶液的质量为___________,溶质的质量分数为____________;
(3)当甲中含有少量乙时,提纯甲的方法是________;
(4)t 3℃ 时等质量的甲、乙、丙三种物质的饱和溶液降温至 t 1℃,所得溶液中溶剂的质量由大到小的顺序为______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某研究小组为探究“影响铁制品锈蚀快慢的因素”,取同浓度的稀氨水和稀醋酸,用右图装置完成表中实验,回答下列问题。
![]()
实验序号 | ① | ② | ③ | ④ |
实验温度/℃ | 25 | 25 | 70 | 70 |
试剂 | 稀氨水 | 稀醋酸 | 稀氨水 | 稀醋酸 |
出现铁锈 所需时间 | 1天 未见锈蚀 | 5分钟 | 1天 未见锈蚀 | 1分钟 |
(1)铁锈的主要成分是________(填化学式)。
(2)实验②和④可探究________因素对铁制品锈蚀快慢的影响;欲探究试剂酸碱性对铁制品锈蚀快慢的影响,应选择的实验是______________(填实验序号)。
(3)根据表中实验现象得出的结论是_________________(写出1点即可)。
(4)影响铁制品的锈蚀快慢除上述因素外,还有______________________(写出1点即可),请设计实验方案_________________________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
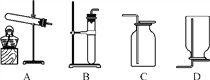
【题目】小明在市场看到,鱼老板将一勺白色粉末加入水中,水中奄奄一息的鱼很快张开嘴,活蹦乱跳起来,小明对这种“白色粉末”很感兴趣,与小刚进行了相关探究。
【查阅资料】这种“白色粉末”的主要成分是过碳酸钠(化学式为Na2CO4),常温下,与水反应生成氧气。
【实验1】小明选用如图所示装置中的________(填序号)进行过碳酸钠与水的反应并收集产生的气体,经检验该气体是氧气,检验方法是______________________________________________________。
【提出问题】过碳酸钠与水反应后得到的溶液M中溶质的成分是什么?
【作出猜想】根据过碳酸钠与水的组成作出三种猜想。
猜想一:Na2CO3;猜想二:NaOH;猜想三:Na2CO3和NaOH。
【实验2】小明取溶液M,滴加CaCl2溶液,观察到有白色沉淀生成,他认为白色沉淀是CaCO3,溶液中一定含有Na2CO3。小刚提出质疑,产生的白色沉淀不一定是CaCO3,他的理由是_________________________________。
【实验3】小刚取溶液M,滴加稀HCl,观察到________________,证明溶液中一定含有Na2CO3,从而否定了猜想二。Na2CO3与稀HCl反应的化学方程式为________________________。
【实验4】为进一步确定溶液M中是否含有NaOH,他们向溶液M中滴加CaCl2溶液至不再产生沉淀为止,取上层溶液,加入________________,无明显现象。证明溶液中无NaOH溶液,猜想一正确。该实验中用CaCl2溶液而不用饱和石灰水,原因是______________________________________________________。
【反思拓展】
(1)根据过碳酸钠的性质,保存时应注意防潮。
(2)检验A、B两种物质是否同时存在,一定要考虑二者性质的互相干扰问题。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com