
【题目】在一定条件下,NH3可以燃烧,且该反应能放出大量的热。下表是测定的部分数据
纯净物 | NH3 | O2 | H2O | X |
反应前质量/g | 1.7 | 3 | 0 | 0 |
反应后质量/g | 0 | 0.6 | 2.7 | 待测 |
根据数据可以判断下列选项正确的是: ( )
A. 反应后X的质量是2gB. X是由氮元素组成
C. X是由氮元素和氧元素组成D. X是由氮元素.氢元素.氧元素组成
【答案】B
【解析】
A、根据质量守恒定律,参加反应的各物质的质量总和等于反应后生成各物质的质量总和,则![]() ,则待测值为1.4g,则反应后X的质量是1.4g,故A不正确;
,则待测值为1.4g,则反应后X的质量是1.4g,故A不正确;
B、由表格中数据可知,反应前后氨气减少了1.7g,为反应物,氧气减少![]() ,为反应物,水增加了2.7g,为生成物,反应后X的质量是1.4g,则X是生成物,反应是氨气和氧气点燃生成和水和氮气,则X是由氮元素组成,故B正确;
,为反应物,水增加了2.7g,为生成物,反应后X的质量是1.4g,则X是生成物,反应是氨气和氧气点燃生成和水和氮气,则X是由氮元素组成,故B正确;
C、根据质量守恒定律,参加反应的各物质的质量总和等于反应后生成各物质的质量总和,则![]() ,则待测值为1.4g,则X是氮气,由氮元素组成,故C不正确;
,则待测值为1.4g,则X是氮气,由氮元素组成,故C不正确;
D、由C选项分析可知,X是氮气,由氮元素组成,故D不正确。故选B。


科目:初中化学 来源: 题型:
【题目】除去粗盐中难溶性杂质后,得到的固体中除了NaCl还含有少量的可溶性杂质MgCl2、CaCl2,某同学为除去可溶性杂质,将该固体加水溶解形成溶液A,并设计如下方案:
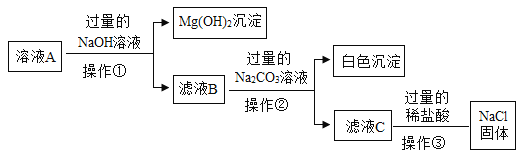
(1)操作①、操作②指的是_____
(2)滤液B中的溶质是_____;
(3)操作③中加过量的稀盐酸是为了除去溶液中的_____(填序号);
①NaOH ②Na2CO3 ③MgCl2 ④CaCl2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2019年5月,187个国家签署了限制塑料废物交易协定,应对“白色污染”挑战。已知某种塑料的组成元素中有碳、氢两种元素,还可能有氧、氯元素中的一种或两种。为了测定其组成,某化学兴趣小组进行如下的探究。
(查阅资料)①无水氯化钙固体可做干燥剂;②有机物中的氯元素燃烧后通常转化为氯化氢。
(设计实验)兴趣小组设计并进行了如图所示的实验。(装置气密性良好)
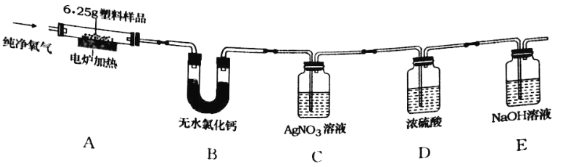
实验过程中,在装置C中观察到________现象,证明该塑料样品中含有氯元素,该反应的化学方程式是________。
(记录数据)6.25g样品在A装置中充分燃烧,反应产物被完全吸收后,测得相关实验数据如表。
装置 | B | C | D | E |
反应后装置增加的质量/g | 1.80 | 3.65 | 0.09 | 8.80 |
(分析与结论)根据以上数据分析与计算,6.25g样品中氢元素的质量为________g,该塑料样品的组成元素是________。
(反思评价)电炉加热前要先通一会儿氧气,目的是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室有碳酸钠和碳酸钙的固体混合物75g,使之与500g质量分数为14.6%的盐酸充分反应,将反应后的溶液蒸干得到82.7g固体。则原混合物中金属元素的质量分数为( )
A. 44%B. 46%C. 50%D. 55%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C、D、E、F、G、H、I都是初中化学学过的物质.其中E、F、H均为黑色固体,B为紫红色固体,D为蓝色沉淀.他们之间有如图的转化关系(部分生成物已省去).

(1)用化学式表示D的组成______ ;
(2)F→G的反应类型______;
(3)写出F→E的化学方程式_______________-;
(4)写出G→I的化学方程式______________
(5)指出B的一种用途______.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】N(NO2)3是科学家2011年发现的一种新型火箭燃料。请回答下列问题:
(1)组成N(NO2)3的元素是:___________。
(2)N(NO2)3分子中原子的个数比为_____________。
(3)N(NO2)3的相对分子质量为:_______________。
(4)N(NO2)3中氮元素的质量分数为_____________。
(5)100Kg的N(NO2)3中氮元素的质量为__________Kg。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】人类生活离不开金属.
(1)铁是生活中常用的金属.如图是某“取暖片”外包装的图片.该“取暖片”中发热剂主要成分有铁粉、活性炭、氯化钠、水等,其发热是利用铁生锈时会放热.

①发热剂需接触到空气才会发热,原因是铁要与 、 等物质共同作用才会生锈.
②推测发热剂成分中氯化钠的作用是 .
(2)应用金属活动性顺序能帮助我们进一步学习金属性质.已知下列各组物质间均能发生置换反应.
A.Fe和CuSO4溶液 B.Mg和MnSO4溶液 C.Mn和FeSO4溶液
①写出Fe和CuSO4溶液反应的化学方程式 .
②Mn、Fe、Mg、Cu四种金属的活动性由强到弱的顺序 .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】 A和C都是常见的黑色粉末,A、B、E中含有同一元素,红色固体 D能发生如下转化:
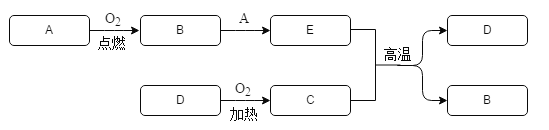
(1)则A是_____,C是_____,D是_____。
(2)写出下列反应的化学方程式:A+B→E:_____;C+E→D+B:_____。该反应属于_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究。
(产品与原理)该厂采用“侯氏制碱法”生产化工产品——纯碱(Na2CO3)和化肥NH4Cl。
生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3和NH4Cl的混合物,反应为:NaCl(饱和)+ NH3 + CO2 + H2O = NaHCO3↓+ NH4Cl;分离出NaHCO3晶体,加热制得纯碱。
(生产流程)

(相关资料)
(1) NH4Cl ![]() NH3↑+HCl↑
NH3↑+HCl↑
(2) 已知20℃时有关物质的溶解度如下(气体指1体积水中能溶解的气体体积)
物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
(问题讨论):
(1)氨碱工业最关键的一步是:在加压的条件下不断向饱和的氨盐水中通入二氧化碳气体,溶液中会有碳酸氢钠晶体析出。试分析该流程需要加压条件的原因是:________。流程中加入过量氢氧化钠目的是________。操作II的名称叫________。
(2)反应①中发生了两个反应,写出其中的一个化学方程式:________________。
(3)反应③中得到纯碱的化学方程式为:_________________________________。
(4)上述生产流程中可循环使用的是________(填序号)。
A 气体C B 溶液D C 氢氧化镁 D 化肥NH4Cl
(5)在氨碱工业处理剩余的氯化铵溶液时。为何不直接蒸发结晶析出氯化铵固体?_________。
(组成确定)
(1)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化。
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀。由上述实验可确定纯碱样品含有杂质________(写化学式)。
(3)某研究性学习小组对刚生产出的纯碱产品进行检测。取22克该样品于烧杯中,加水将其溶解,然后逐滴加入溶质质量分数为14.6%的稀盐酸并不断振荡。
首先发生的反应是:Na2CO3+HCl=NaHCO3+NaCl;然后发生的反应是:NaHCO3+HCl= NaCl+H2O+CO2↑;
在上述过程中烧杯中溶液质量与加入稀盐酸质量的关系如图甲所示。

请你根据图甲提供的信息,计算出反应产生的二氧化碳的质量________;计算该样品中纯碱的质量分数________(计算结果用百分数表示,保留到小数点后一位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com