
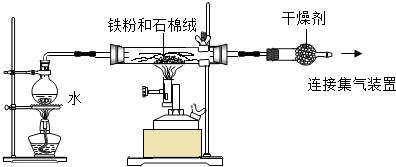
分析 实验一:(1)铁能与空气中的氧气发生反应,先加热酒精灯利用生成的水蒸气排除装置中的空气;装置中石棉绒可以增大水蒸气与铁粉的接触面积;
(2)分析两个反应可知产生四氧化三铁需要的铁少,因此可依据3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 ,由氢气的质量求出需要铁的质量;
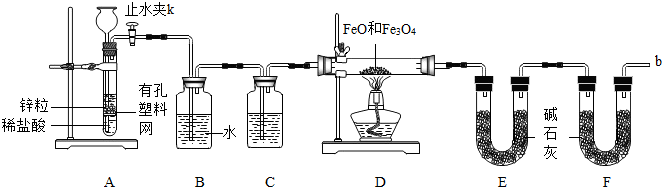
实验二:(1)根据检验气密性的方法进行分析解答;
(2)根据锌和盐酸反应产生氯化锌和氢气写出反应 方程式;
(3)根据氢气容易发生爆炸分析使用注意事项;
(4)根据产生的氢气会混有杂质,要进行除杂、干燥分析装置的作用;
(5)根据碱石灰会吸收空气中的二氧化碳和水蒸气导致E装置质量增加大,会使测定的水多,影响实验的沉淀分析;
(6)根据反应完全后干燥管E的质量增加了4.5g,说明生成水为4.5g,则意味着则完全反应后固体减少的质量就是水中氧元素的质量计算剩余固体的质量;根据混合物中氧元素的质量及水中氧元素的质量相等计算四氧化三铁的质量.
解答 解:实验一:(1)铁能与空气中的氧气发生反应,因此为了排除氧气的干扰,先加热酒精灯利用生成的水蒸气排除装置中的空气;装置中石棉绒可以增大水蒸气与铁粉的接触面积,
故答案为:酒精灯;先产生水蒸气,排尽空气;增大铁粉与水蒸气的接触面积;
(2)解:设生成0.04g氢气至少需要铁的质量为x
3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2
168 8
x 0.04g
$\frac{168}{x}$=$\frac{8}{0.04g}$ x=0.84g
故答案为:0.84;
实验二(1)检查A装置气密性的方法:关闭止水夹K,从长颈漏斗向试管内加水,至长颈漏斗中管内的液面高于管外液面,静置一段时间,形成的液柱不下降,即液面高度差不变,则气密性良好;
故答案为:不变
(2)锌和盐酸反应产生氯化锌和氢气;
故反应的方程式为:Zn+2HCl=ZnCl2+H2↑
(3)因为氢气在点燃时容易发生爆炸,验纯为了安全,在点燃酒精灯之前,在F装置出口b处必须验纯;
故答案为:验纯;
(4)产生的氢气会混有氯化氢和水蒸气,因此要先通过水除去氯化氢,再通过浓硫酸除去水蒸气;
故答案为:浓硫酸;除去HCl气体;
(5)碱石灰会吸收空气中的二氧化碳和水蒸气导致E装置质量增加大,会使测定生成的水多,使测定的结果偏大;
故答案为:防止空气中的二氧化碳和水被E吸收;偏大;
(6)反应完全后干燥管E的质量增加了4.5g,说明生成水为4.5g,水中氧元素的质量就是混合物中减少的氧元素的质量,氧元素的质量为:4.5g×$\frac{16}{18}$×100%=4g 因此剩余固体的质量就是混合物的质量-氧元素的质量,即15.2g-4g=11.2g;
设四氧化三铁的质量为x,则氧化亚铁的质量为(15.2g-x)
x×$\frac{64}{232}$×100%+(15.2g-x)×$\frac{16}{72}$×100%=4g x=11.6g;
故答案为:11.2; 11.6.
点评 本题属于信息题的考查,考查了物质性质的探究,依据题目的信息及已有的知识进行分析计算,难度较大,能够考查学生的能力.


科目:初中化学 来源: 题型:选择题
| A. | 单质是白一种元素组成的纯净物,所以甴一种元素组成的物质一定是单质 | |
| B. | 酸具有相似的化学性质是因为它们都含有氢离子,所以含有氢元素的物质化学性质一定相似 | |
| C. | 有机物完全燃烧会产生二氧化碳,所以燃烧会产生二氧化碳的物质一定是有机物 | |
| D. | 化学变化过程分子种类会发生改变,所以分子种类发生改变的变化一定是化学变化 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 两试管中都先出现少量白色沉淀,后沉淀消失 | |
| B. | 两试管中都先无明显现象,后出现少量白色沉淀 | |
| C. | 两试管中都先出现少量白色沉淀,后甲试管中的沉淀消失,乙试管中的沉淀不消失 | |
| D. | 两试管中都先无明显现象,后甲试管中产生少量气泡,乙试管中出现少量沉淀 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 溶液 | 甲+乙 | 乙+丙 | 丙+丁 | 甲+丁 |
| 现象 | 无明显现象 | 白色沉淀 | 白色沉淀 | 无色气体 |
| A. | HCl、BaCl2、H2SO4Na2CO3 | B. | H2SO4、HCl、BaCl2、Na2CO3 | ||
| C. | HCl、H2SO4、BaCl2、Na2CO3 | D. | H2SO4、Na2CO3、HCl、BaCl2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
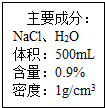 如图是一瓶医用注射盐水标签的部分内容.
如图是一瓶医用注射盐水标签的部分内容.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
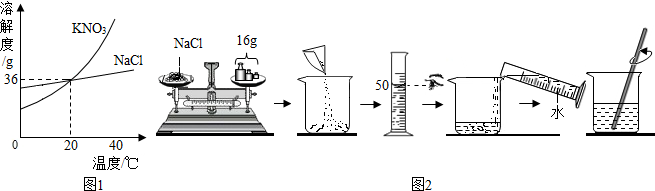
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com