
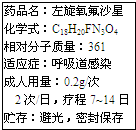
 新药左旋氧氟沙星(C3H8FN2O4)可用于治疗敏感菌引起的呼吸道感染,其说明书中部分内容如图.
新药左旋氧氟沙星(C3H8FN2O4)可用于治疗敏感菌引起的呼吸道感染,其说明书中部分内容如图.分析 (1)根据左旋氧氟沙星(C18H20FN3O4)组成和有机物的定义解答;
(2)根据化学式计算氧元素的质量分数;
(3)根据标签的用量和疗程解答;
解答 解:(1)左旋氧氟沙的化学式为C18H20FN3O4,它是由5种元素组成的有机物;
(2)左旋氧氟沙星中,氧元素的质量分数为=$\frac{16×4}{12×18+20+19+14×3+16×4}×100%$×100%=17.7%;
(3)根据标签说明,成人呼吸道感染患者,一个疗程最少应服用左旋氧氟沙星0.2g×2×7=2.8g
故答为:(1)5,有机物;(2)17.7%;(3)2.8.
点评 本题难度不大,考查同学们结合标签新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 溶液的溶质的质量分数减小 | B. | A溶解度减小 | ||
| C. | 溶质的质量减少 | D. | 溶液的密度增大 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 某粒子的结构示意图如图所示,对该粒子的说法错误的是( )
某粒子的结构示意图如图所示,对该粒子的说法错误的是( )| A. | 核外电子数为12 | |
| B. | 该粒子的结构示意图为原子结构示意图 | |
| C. | 最外层电子数为2 | |
| D. | 该粒子所形成的离子其符号为Mg2- |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | BaCO3与HCl溶液 | B. | BaCl2溶液与K2SO4溶液 | ||
| C. | CO2与KOH溶液 | D. | Na2SO4溶液与KNO3溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
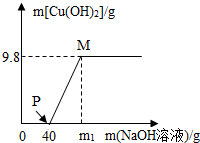 向含CuCl2和HCl的100g混合溶液中,逐滴加入溶质质量分数为40%NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,据图回答:
向含CuCl2和HCl的100g混合溶液中,逐滴加入溶质质量分数为40%NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,据图回答:查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com