【答案】
分析:(1)在实验室用过氧化氢与二氧化锰来制取氧气时,二氧化锰是催化剂,起的作用是催化作用.
(2)要证明高锰酸钾溶液的紫红色是MnO
4-的颜色,而不是K
+的颜色,就要在溶液中实验,而①是固体反应,故没有意义.若加热高锰酸钾晶体完全分解后,把剩余物溶于水,观察颜色的不同,就可以了.
(3)要判断是否是由于溶液中NaOH的质量分数过大,而引起的颜色变化,只要计算出反应后氢氧化钠的质量分数,看是否大于24%即可.已知过氧化钠的质量,氢氧化钠的质量很容易计算,而氢氧化钠溶液的质量,需要注意反应过程中逸出了氧气,应为加入的总质量减去氧气的质量.
要判断是否是由于反应后的溶液中有过氧化氢存在,而引起颜色的变化,只要证明溶液中有过氧化氢即可.根据所学知识,向溶液中加入二氧化锰,看是否产生氧气即可.
也可从题目所给的信息:当NaOH溶液的质量分数大于24%时,酚酞显无色;H
2O
2具有漂白性,能使有色有机物氧化褪色来考虑,氢氧化钠溶液呈碱性,能使石蕊变蓝色,而石蕊试液本身是紫色,若加入紫色石蕊试液也褪色,那就说明是过氧化氢的作用.
解答:解答:(1)因在实验室用过氧化氢与二氧化锰制取氧气时,二氧化锰是催化剂.
故答案为:催化作用
(2)要证明高锰酸钾溶液的紫红色是MnO
4-的颜色,而不是K
+的颜色,就要在溶液中进行实验,而①始终是固体,故没有意义.
氯化钾溶液中有K
+,但没有颜色,故表明溶液中K
+无色,②有意义.
③的目的是为④创造条件,③中说明锌与K
+不反应,④中加入锌粉褪色,说明不是K
+作用,运用了排除法.故③④都有意义.
故答案为:①
(3)①解:设 将0.39gNa
2O
2溶解在10.0mL过量水中,生成NaOH的质量为X,O
2的质量为Y
写 2Na
2O
2 +2H
2O=4NaOH+O
2↑
找 156 160 32
0.39g X Y
列
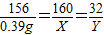
解 解得:X=0.40 g Y=0.08 g
则氢氧化钠的质量分数为:
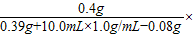
100%≈3.9%
因3.9%<24%,故红色褪去是由于NaOH的质量分数过大引起的说法是不正确的.
故答案为:不正确.
②证明过氧化氢存在,可联想实验室制取氧气的原理,2H
2O
2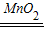
2H
2O+O
2↑.
也可从题目所给的信息出发,氢氧化钠溶液呈碱性,能使石蕊变蓝色,而石蕊试液本身是紫色,若加入紫色石蕊试液也褪色,那就说明是过氧化氢的作用.
故答案为:(答案一) 取反应后的溶液少量于试管中,加入少量MnO
2粉末,然后把带火星的木条伸入试管中,若木条复燃,说明溶液中含有过氧化氢,红色褪去的原因是由于反应后的溶液中有过氧化氢存在.若木条不复燃,说明溶液中不含有过氧化氢,红色褪去的原因就不是由于过氧化氢存在引起的.
(答案二) 取反应后的溶液少量于试管中,加入少量紫色石蕊试液,若看到溶液由紫色先变蓝色,然后褪色,说明褪色的原因是由于反应后的溶液中有过氧化氢存在.若看到溶液变蓝后不退色,就说明褪色的原因不是由于过氧化氢存在引起的.
点评:该题属于信息题,主要考查同学们的分析问题的能力和语言表达能力.有关计算,尤其主要反应后溶液的溶质质量分数的计算,是易错点.

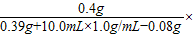 100%≈3.9%
100%≈3.9%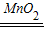 2H2O+O2↑.
2H2O+O2↑.

 优学名师名题系列答案
优学名师名题系列答案