
【题目】完成下列变化的化学方程式,并按要求填空.
(1)镁条在氧气中燃烧:;其基本反应类型是: .
(2)高温煅烧石灰石:;其基本反应类型是: .
(3)工业炼铁的主要原理是一氧化碳跟三氧化二铁在高温下反应:;该反应中气体的化学计量数之比为: .
(4)小苏打(NaHCO3)与盐酸的反应:;小苏打的用途有 .
(5)将少量硫酸铵晶体与熟石灰混合研磨:;研磨用的器皿是: .
【答案】
(1)2Mg+O2 ![]() 2MgO;化合反应
2MgO;化合反应
(2)CaCO3 ![]() CaO+CO2↑;分解反应
CaO+CO2↑;分解反应
(3)Fe2O3+3CO ![]() 2Fe+3CO2;1:1
2Fe+3CO2;1:1
(4)NaHCO3+HCl=NaCl+H2O+CO2↑;可用作发酵粉等
(5)(NH4)2SO4+Ca(OH)2=CaSO4+2NH3↑+2H2O;研钵
【解析】解:(1)镁条在氧气中燃烧生成氧化镁,反应的化学方程式为:2Mg+O2 ![]() 2MgO;该反应符合“多变一”的特征,属于化合反应.(2)高温煅烧石灰石生成氧化钙和二氧化碳,反应的化学方程式为:CaCO3
2MgO;该反应符合“多变一”的特征,属于化合反应.(2)高温煅烧石灰石生成氧化钙和二氧化碳,反应的化学方程式为:CaCO3 ![]() CaO+CO2↑;该反应符合“一变多”的特征,属于分解反应.(3)工业上用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为Fe2O3+3CO
CaO+CO2↑;该反应符合“一变多”的特征,属于分解反应.(3)工业上用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为Fe2O3+3CO ![]() 2Fe+3CO2;该反应中气体的化学计量数之比为3:3=1:1.(4)小苏打是碳酸氢钠的俗称,碳酸氢钠和稀盐酸混合生成氯化钠、水和二氧化碳,反应的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑;小苏打还可以可用作发酵粉等.(5)硫酸铵晶体与熟石灰混合研磨生成氨气、水和硫酸钙,反应的化学方程式为:(NH4)2SO4+Ca(OH)2=CaSO4+2NH3↑+2H2O;研磨用的器皿是研钵. 所以答案是:(1)2Mg+O2
2Fe+3CO2;该反应中气体的化学计量数之比为3:3=1:1.(4)小苏打是碳酸氢钠的俗称,碳酸氢钠和稀盐酸混合生成氯化钠、水和二氧化碳,反应的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑;小苏打还可以可用作发酵粉等.(5)硫酸铵晶体与熟石灰混合研磨生成氨气、水和硫酸钙,反应的化学方程式为:(NH4)2SO4+Ca(OH)2=CaSO4+2NH3↑+2H2O;研磨用的器皿是研钵. 所以答案是:(1)2Mg+O2 ![]() 2MgO;化合反应;(2)CaCO3
2MgO;化合反应;(2)CaCO3 ![]() CaO+CO2↑;分解反应;(3)Fe2O3+3CO
CaO+CO2↑;分解反应;(3)Fe2O3+3CO ![]() 2Fe+3CO2;1:1;(4)NaHCO3+HCl=NaCl+H2O+CO2↑;可用作发酵粉;(5)(NH4)2SO4+Ca(OH)2=CaSO4+2NH3↑+2H2O;研钵.
2Fe+3CO2;1:1;(4)NaHCO3+HCl=NaCl+H2O+CO2↑;可用作发酵粉;(5)(NH4)2SO4+Ca(OH)2=CaSO4+2NH3↑+2H2O;研钵.
【考点精析】利用书写化学方程式、文字表达式、电离方程式对题目进行判断即可得到答案,需要熟知注意:a、配平 b、条件 c、箭号.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:初中化学 来源: 题型:
【题目】锶在元素周期表中某些信息如图所示,下列说法正确的是( ) 
A.锶的元素符号为Sr
B.锶属于非金属元素
C.锶的相对原子质量为87.62g
D.锶的中子数为38
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某研究性学习小组在学习金属铁的知识后,为了解铜及其常见化合物的性质,运用类比的思想提出了如下问题,并进行探究.请帮助完成下列有关研究并填写有关空白. 【提出问题】
①铁能与稀硫酸反应产生氢气,铜能吗?铜与浓硫酸会发生反应吗?
②铁在潮湿的空气中易生锈,铜“生锈”需要什么条件?
③氧化铁能够被一氧化碳还原,氧化铜可以吗?氧化铜能直接转化为氢氧化铜吗?氧化铜还有哪些性质?
④有哪些途径可以由铜逐步转变为氢氧化铜?
【查阅资料与问题解决】
①铜不能与稀硫酸发生置换反应,是因为在金属活动性顺序表中,铜排在之后.
铜能与浓硫酸发生反应,其反应方程式为:
Cu+2H2SO4(浓) ![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
此反应中化合价升高的元素是 .
②铜在潮湿的空气中也能“生锈”形成铜绿,铜绿的主要成分为 Cu2(OH)2CO3 . 由此可以推测:铜“生锈”过程中,参与反应的物质有铜、氧气、水和 .
③氧化铜可以在加热的条件下被一氧化碳等还原成铜,其与一氧化碳反应的化学方程式为;氧化铜不能与水反应生成氢氧化铜,但能与硫酸、盐酸等发生复分解反应形成相应的 铜盐;在高温下,氧化铜能分解成砖红色的氧化亚铜(Cu2O)和氧气,反应的化学方程式为
④由铜转化为氢氧化铜,从化学反应的原理看,可以是流程 I:Cu ![]() CuSO4
CuSO4 ![]() Cu(OH)2;
Cu(OH)2;
也可以是流程Ⅱ:
Cu ![]() CuO
CuO ![]() CuSO4
CuSO4 ![]() Cu(OH)2;
Cu(OH)2;
与流程 I相比,流程Ⅱ的优点是和 .
还可以有更多的流程.若流程Ⅲ与流程 I 相比,也是两步反应,但第一步与铜反应的
试剂不同,则流程Ⅲ中第一步反应的化学方程式为 .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了验证铁、铜两种金属的活动性差异,如图所示取2支试管分别进行有关实验,若要观察到现象的显著差异,所用液体合理的是( ) 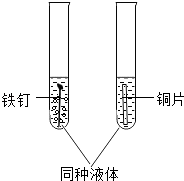
A.蒸馏水
B.稀盐酸
C.酒精水溶液
D.硫酸钠溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】太湖水经苏州胥江水厂处理的大致流程如下. 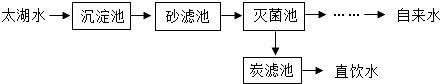
(1)从沉淀池中出来的水经过沙滤池的操作称为: . 经沙滤池后的水在灭菌池中被通入的臭氧(O3)进行杀菌处理,再经一系列后续处理成为自来水进入千家万户;在深度处理区,炭滤池中活性炭的作用是:
(2)有人做了如下的甲、乙2个实验.因在乙实验中得到一些有色沉淀,于是就说“自来水没有纯水好”.某校兴趣小组同学为验证上述说法的真伪,又增做了丙和丁2个对比试验(均在室温下) 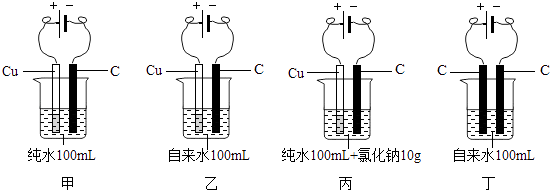
项目 | 甲 | 乙 | 丙 | 丁 |
与电源正极相连的电极附近区域 | 现象不明显 | 有小气泡产生,渐有有色沉淀生成,沉淀颜色逐渐加深 | 有刺激性气味的较多气泡产生,且有许多有色沉淀生成 | 有小气泡产生 |
与电源负极相连的电极附近区域 | 现象不明显 | 有小气泡产生 | 有较多气泡产生 | 有小气泡产生,渐有少量沉淀生成 |
①上述实验中能量转换的形式为: .
②由上述4个对比试验可知:装置(填序号)中水样的导电能力最强.在上述对比试验中,生成有色沉淀的主要原因是:
(3)水厂的检测人员用浑浊度仪测出该厂自来水中颗粒物的量为0.55;用pH仪测出水质的度为7.66,此时水质呈弱性.这是因为自来水中含有了多种天然水溶解的对人体有益的微量元素的缘故.且在合格标准内.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在化学反应A+B===C+D中,若12 g A与一定量的B恰好完全反应,生成28 g C和2 g D,则参加反应的B的质量为( )
A. 8 g B. 18 g C. 28 g D. 30
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某学生在用氯酸钾制氧气的实验中,错把高锰酸钾当成二氧化锰混入氯酸钾内,其结果是( )
A.反应速度加快,生成氧气的量不变 B.反应速度加快,生成氧气的量增多
C.反应速度不变,生成氧气的量不变 D.反应速度不变,生成氧气的量增多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com