
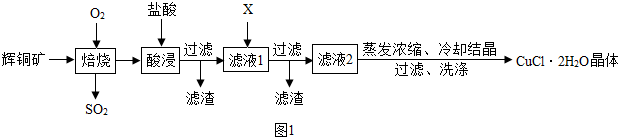
分析 (1)硫化亚铜和氧气在高温条件下反应生成氧化铜和二氧化硫;
二氧化硫和氢氧化钠反应生成亚硫酸钠和水;
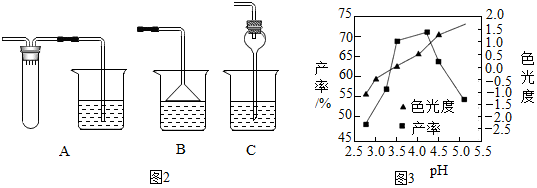
不同的实验装置,功能不同;
(2)酸浸时,氧化铜和稀盐酸反应生成氯化铜和水,氧化铁和稀盐酸反应生成氯化铁和水;
(3)向氯化铜和氯化铁的混合溶液中加入适量氨水时,铁离子能够以氢氧化铁沉淀的形式从溶液中析出,而铜离子不能形成沉淀;
(4)氯化铜晶体溶于水,不溶于酒精;
(5)根据图中提供的信息可以判断相关方面的问题;
利用pH试纸可以测定溶液的酸碱度.
解答 解:(1)焙烧中生成黑色固体,是因为硫化亚铜和氧气反应生成了氧化铜,反应的化学方程式为:Cu2S+2O2$\frac{\underline{\;高温\;}}{\;}$2CuO+SO2;
在实验室中可选用NaOH溶液吸收尾气中的二氧化硫,反应的化学方程式为:SO2+2NaOH=Na2SO3+H2O;
吸收过程中为了防止液体倒吸,可以选用如图1装置中A,或B,或C.
故填:Cu2S+2O2$\frac{\underline{\;高温\;}}{\;}$2CuO+SO2;SO2+2NaOH=Na2SO3+H2O;A,或B,或C.
(2)酸浸时发生的化学方程式为:CuO+2HCl═CuCl2+H2O,Fe2O3+6HCl═2FeCl3+3H2O.
故填:CuO+2HCl=CuCl2+H2O,Fe2O3+6HCl═2FeCl3+3H2O.
(3)物质X可以选用下列物质中的NH3•H2O,向氯化铜和氯化铁的混合溶液中加入适量氨水时,铁离子能够以氢氧化铁沉淀的形式从溶液中析出,而铜离子不能形成沉淀.
故填:d.
(4)洗涤晶体时,用乙醇代替蒸馏水的目的是防止氯化铜晶体溶于水,并缩短干燥所需时间.
故填:防止氯化铜晶体溶于水.
(5)制备时应控制pH的合理范围是3.5-4.0,pH在3.5-4.0时,CuCl2•2H2O晶体的色光度在合格范围内,同时产率较高;
实验室用pH试纸测定溶液pH的操作方法为:用洁净干燥的玻璃棒蘸取溶液,滴在pH试纸上,把变色的pH试纸与标准比色卡对照,即可得溶液的pH.
故填:3.5-4.0;用洁净干燥的玻璃棒蘸取溶液,滴在pH试纸上,把变色的pH试纸与标准比色卡对照,即可得溶液的pH.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
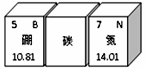 如图是元素周期表的部分,其中碳元素部分信息缺失,下列有关该元素认识错误的是( )
如图是元素周期表的部分,其中碳元素部分信息缺失,下列有关该元素认识错误的是( )| A. | 该元素对应原子的质子数为6 | B. | 该元素属于金属元素 | ||
| C. | 该元素可以组成多种单质 | D. | 有机物中一定还有该元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 称量精盐时天平指针偏左 | B. | 用量筒量取溶解所需水时仰视读数 | ||
| C. | 过滤时液面高于滤纸边缘 | D. | 蒸发时没有使用玻璃棒搅拌 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com