
【题目】如图是A、B、C三种物质的溶解度曲线,下列说法正确的是( )
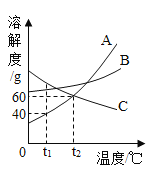
A.A、B、C三种物质的溶解度都随温度的升高而增大
B.A的溶解度大于C的溶解度
C.升高温度可使接近饱和的C溶液变为饱和
D.t2℃时,A、C溶液的溶质的质量分数相等
 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:初中化学 来源: 题型:
【题目】高锰酸钾在生产、生活中有广泛的应用。实验小组同学查阅资料得知,草酸(H2C2O4)可使滴有硫酸的高锰酸钾溶液褪色,但不同条件下褪色时间不同,即反应的速率不同。小组同学进行了如下探究。
(提出问题)影响该反应反应速率的因素有哪些?
(作出猜想)影响该反应反应速率的因素有温度、催化剂、硫酸的浓度等。
(查阅资料)硫酸锰(MnSO4)可作该反应的催化剂。
(进行实验)取A、B、C、D 4支试管,每支试管中分别加入4mL 0.08% 的KMnO4 溶液、0.4 mL 的硫酸、1mL 0.09% 的 H2C2O4 溶液。

(实验记录)
序号 | 所滴硫酸浓度 | 温度 | 催化剂 | 高锰酸钾完全褪色时间 |
A | 98% | 室温 | 无 | 72s |
B | 65% | 室温 | 无 | 129s |
C | 65% | 50℃ | 无 | 16s |
D | 65% | 室温 | MnSO4 | 112s |
(解释与结论)
(1)草酸使高锰酸钾溶液褪色反应的化学方程式如下,请在横线上补全方程式。
2KMnO4 + 5H2C2O4 + 3H2SO4 == K2SO4 + 2MnSO4 + 10_______+ 8H2O
(2)4支试管中作为对照实验的是_______(填序号,下同)。
(3)设计实验A和B的目的是 ______________________________。
(4)对比实验B和C可得出的结论是_____________________________。
(5)探究催化剂对该反应反应速率影响的实验是____________________________。
(反思与交流)
(6)影响该反应反应速率的因素除温度、催化剂、硫酸的浓度外,还可能有_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是表示在9.8g 10%的稀H2SO4中逐滴滴入10%的Ba(OH)2溶液的变化过程。下列说法正确的是( )
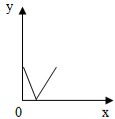
A.X是时间,Y是pH
B.X是水的总质量,Y是H2SO4的质量
C.X是加入Ba(OH)2溶液的质量,Y是沉淀物质的质量
D.X是加入Ba(OH)2溶液的质量,Y是溶液中溶质的质量
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上常采用“双碱法”除去烟气中的![]() ,工业流程示意图如下.
,工业流程示意图如下.
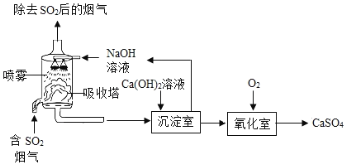
(1)吸收塔中,用NaOH溶液吸收![]() ,化学反应方程式是___.NaOH溶液喷成雾状能充分吸收SO2的原因是_____
,化学反应方程式是___.NaOH溶液喷成雾状能充分吸收SO2的原因是_____
(2)氧化室中,化学反应方程式是_______。
(3)已知部分原料的价格如表所示.
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.90 |
上述工业流程中,处理相同量的![]() ,双碱法所需的原料成本比用NaOH直接吸收更低,原因是___
,双碱法所需的原料成本比用NaOH直接吸收更低,原因是___
(4)某中学化学兴趣小组为测定工厂周围的空气中的二氧化硫含量是否符合国家标准,将![]() 周围空气通入一定含量碘(
周围空气通入一定含量碘(![]() )2.54mg的碘水中,经测定I2与二氧化硫恰好完全反应,该反应的化学方程式是
)2.54mg的碘水中,经测定I2与二氧化硫恰好完全反应,该反应的化学方程式是![]() 。通过计算说明此烟气排放后周围空气中二氧化硫的浓度级别______。
。通过计算说明此烟气排放后周围空气中二氧化硫的浓度级别______。
[资料信息:我国空气质量标准对空气中二氧化硫的浓度级别规定如下表所示(空气中二氧化硫的浓度用单位体积的空气中所含二氧化硫的质量表示)]。
浓度级别 | 标准(mg·m-3) |
一级 | 浓度≤0.15 |
二级 | 0.15<浓度≤0.50 |
三级 | 0.50<浓度≤0.70 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】废弃电路板中含有大量可利用的塑料、玻璃、金属等物质,利用超临界水技术处理废弃电路板,能得到由CuO和Cu2O组成的固体残渣,将残渣进行进一步处理可得硫酸铜晶体等物质。处理流程如图所示。
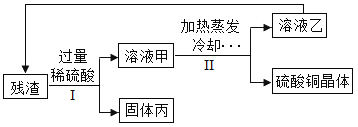
已知:![]()
![]()
(1)固体丙是_________。
(2)溶液甲的溶质有___________。
(3)下列说法不正确的是___________(填字母序号)。
A Ⅱ中含过滤操作,Ⅰ中不含过滤操作
B 溶液甲和溶液乙中均含铜元素
C 残渣的处理流程中,H2SO4和CuSO4实现了循环利用
D 废弃电路板的可回收利用物质中属于有机合成材料的是塑料
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】长沙市北雅中学初三化学兴趣小组对酸碱盐之间发生的复分解反应充满了无限的好奇,加之某些酸碱盐之间发生反应还能产生五彩缤纷的沉淀,如白色沉淀有CaCO3和BaSO4等,蓝色沉淀有Cu(OH)2,这些都引起他们强烈的探究欲望。请写出一个能够生成蓝色沉淀的复分解反应的化学方程式:①_________。
兴趣班指导老师金老师告诉他们:Fe(OH)3是一种红褐色沉淀,而Fe(OH)2却是一种白色沉淀,它们都可以在水中通过发生复分解反应来制得。但是由于Fe(OH)2很不稳定,在水溶液中只要有一点氧气就极易发生反应变成Fe(OH)3,因而要在溶液中制得纯净且稳定的Fe(OH)2是比较困难的。于是,在周未,兴趣班的同学积极探究如何制取纯净且稳定的Fe(OH)2:
实验活动一:
礼礼同学和婷婷同学合作探究,她们用滴管吸取NaOH溶液滴入氯化亚铁溶液中,观察到白色沉淀立即变为灰绿色沉淀,最后变成了红褐色沉淀。鹏鹏同学马上指出了她们失败的原因,你认为得不到稳定的白色沉淀的原因是②_______。
实验活动二:
松松同学和玲玲同学积极思考,精心设计了如图的实验装置,成功制得并观看到了白色的Fe(OH)2沉淀。已知他们用到的实验药品有:NaOH溶液、铁屑、稀H2SO4。
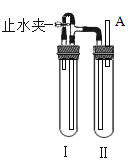
操作方法如下:
(1)在试管Ⅰ里应该加入的试剂是足量铁粉和适量稀硫酸,两者反应的化学方程式为③_______。
(2)在试管Ⅱ里应该加入的试剂是氢氧化钠溶液。
(3)为了制得Fe(OH)2白色沉淀,正确的操作顺序是④__________(填下列序号)。
A 检查装置气密性 B 检查试管Ⅱ出口A处排出的H2的纯度
C 夹紧止水夹 D 在试管Ⅰ和Ⅱ中加入试剂,塞紧塞子,打开止水夹
(4)这样试管Ⅱ中可以看到生成的Fe(OH)2沉淀能较长时间保持白色,其原因是⑤_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室将氯酸钾和二氧化锰的混合物7g放在一起加热制取氧气,充分反应后称得剩余固体的质量为5.08g。求:
(1)生成氧气的质量是__________g。
(2)原混合物中氯酸钾的质量分数是多少_________?(写出详细过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室有一包含杂质的碳酸氢钠样品100g(杂质不含钠元素,受热不变化),其中钠元素质量分数为23%,180℃时,将样品加热一段时间后称得固体质量为87.6g,则分解的碳酸氢钠占原碳酸氢钠的质量分数为(2NaHCO3![]() Na2CO3 + H2O + CO2↑)
Na2CO3 + H2O + CO2↑)
A. 33.6% B. 40% C. 47.3% D. 60%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com