
| A. | Cu粉中混有铁粉(用磁铁吸引) | B. | NaNO3溶液中混有NaCl(AgNO3溶液) | ||
| C. | 碳粉中混有CuO(稀硫酸) | D. | CaO中混有CaCO3(稀盐酸) |
分析 根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答 解:A、铁粉能被磁铁吸引,铜粉不能,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确.
B、NaCl能与AgNO3溶液反应生成氯化银沉淀和硝酸钠,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采用的试剂正确.
C、CuO能与稀硫酸反应生成硫酸铜和水,碳粉不与稀硫酸反应,反而会把原物质除去,不符合除杂原则,故选项所采用的试剂正确.
D、CaO和CaCO3均能与稀盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采用的试剂错误.
故选:D.
点评 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:初中化学 来源: 题型:推断题
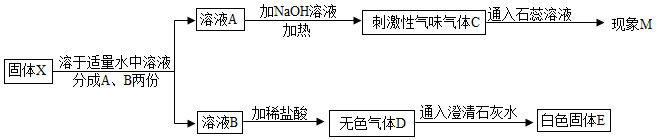
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①是复分解反应 | B. | ②是置换反应 | C. | ③是分解反应 | D. | ④是化合反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 鉴别NH4NO3固体和NaOH固体 | 分别加水溶解 |
| B | 分离Zn和Cu的固体混合物 | 加适量的Cu(NO3)2溶液,过滤 |
| C | 鉴别CO和CH4 | 分别点燃,观察火焰颜色 |
| D | 验证质量守恒定律 | 将镁条点燃,比较燃烧前后固体的质量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
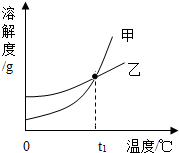 KCl和KNO3的溶解度表及溶解度曲线如图所示,下列说法不正确的是( )
KCl和KNO3的溶解度表及溶解度曲线如图所示,下列说法不正确的是( ) | 温度/℃ | 20 | 30 | 40 | 50 | |
| 溶解度S/g | KCl | 34.0 | 37.0 | 40.0 | 42.6 |
| KNO3 | 31.6 | 45.8 | 63.9 | 85. | |
| A. | 甲表示KNO3溶解度曲线 | |
| B. | 温度t1应在20~30℃之间 | |
| C. | 50℃时,30gKNO3加入50g水,充分溶解,再降温到30℃,有晶体析出 | |
| D. | 40℃时,10gKCl加入20g水中,可得到溶质质量分数为33.3%的溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
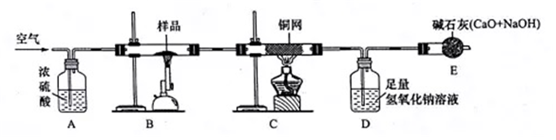
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com