
分析 (1)实验①说明酸性条件下,次氯酸钠把碘离子氧化生成碘单质,同时自身被还原生成氯离子;
(2)实验②说明碘单质把亚硫酸根离子氧化生成硫酸根离子,自身被还原生成碘离子,根据亚硫酸钠和转移电子的关系式计算转移电子的物质的量;
(3)氧化还原反应中,氧化剂的氧化性强于氧化产物的氧化性;
(4)原子得电子,化合价降低元素所在的反应物是氧化剂,原子失电子,化合价升高元素所在的反应物是还原剂.
解答 解:(1)实验①说明酸性条件下,次氯酸钠把碘离子氧化生成碘单质,同时自身被还原生成氯离子,该反应中,次氯酸根离子得电子作氧化剂,碘离子失电子是还原剂,氧化产物是碘,所以氧化性强弱为:ClO->I2,反应离子方程式为:ClO-+2I-+2H+=I2+Cl-+H2O,故答案为:ClO-+2I-+2H+=I2+Cl-+H2O;
(2)实验②说明碘单质把亚硫酸根离子氧化生成硫酸根离子,自身被还原生成碘离子,氧化剂是碘,还原剂是亚硫酸钠,氧化产物是硫酸根离子,所以氧化性强弱为:I2>SO42-,反应离子方程式为:H2O+I2+SO32-=SO42-+2I-+2H+,
设转移电子的物质的量为x.
H2O+SO32-+I2=SO42-+2I-+2H+转移电子
1mol 2mol
0.5mol/L×0.004L x
$\frac{1mol}{0.5mol/L×0.004L}$=$\frac{2mol}{x}$=0.004mol,
答:转移电子的物质的量是0.004 mol;
(3)反应①:ClO-+2I-+2H+=I2+Cl-+H2O,氧化性强弱为:ClO->I2,反应②:H2O+I2+SO32-=SO42-+2I-+2H+,氧化性强弱为:I2>SO42-,综合以上得出结论:SO42->I2>ClO-,故答案为:SO42-、I2、ClO-;
(4)反应2Al+2OH-+2H2O=2AlO2-+3H2↑中,失电子化合价升高元素是Al元素,发生氧化反应:2Al+8OH--6e-=2AlO2-+4H2O(或Al+4OH--3e-=AlO2-+2H2O),
失电子,化合价降低元素是H元素,发生还原反应,即6H2O+6e-=6OH-+3H2↑(2H2O+2e-=2OH-+2H2↑),
故答案为:2Al+8OH--6e-=2AlO2-+4H2O(或Al+4OH--3e-=AlO2-+2H2O);6H2O+6e-=6OH-+3H2↑(2H2O+2e-=2OH-+2H2↑).
点评 本题以实验设计为载体考查了物质氧化性强弱的判断,明确“同一化学反应中,氧化剂的氧化性大于氧化产物的氧化性”是解本题的关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 如图是空气的成分示意图,请你图示回答下列问题.
如图是空气的成分示意图,请你图示回答下列问题. 查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
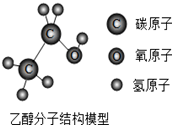
| A. | 乙醇分子是由碳、氢、氧元素组成 | |
| B. | 乙醇是由碳原子、氢原子、氧原子构成 | |
| C. | 乙醇中质子数和电子数的比是1:1 | |
| D. | 每个乙醇分子中都含有8个原子核 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com