4.6g某物质在空气中完全燃烧生成8.8gCO2和5.4gH2O,则
(1)共消耗氧气多少克?______
(2)计算说明该物质的组成及各元素的质量.______
(3)写出其化学式.______.
解:
(1)参加反应的氧气的质量为:8.8g+5.4g-4.6g=9.6g.故填:9.6g.
(2)8.8g二氧化碳中碳元素的质量为:8.8g×
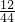
×100%=2.4g,则氧元素的质量为:8.8g-2.4g=6.4g.
5.4g水中氢元素的质量为:5.4g×
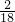
×100%=0.6g,则氧元素的质量为:5.4g-0.6g=4.8g.
该物质中,碳元素的质量是2.4g,氧元素的质量是6.4g+4.8g=11.2g,氢元素的质量是0.6g,由此可知,该物质中含有碳元素、氢元素和氧元素,其中氧元素的质量为:11.2g-9.6g=1.6g.
故填:该物质由碳元素、氢元素和氧元素组成,质量分别是2.4g、0.6g、1.6g.
(3)该物质中,碳原子、氢原子和氧原子的个数比为:

:
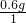
:
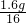
=2:6:1.该物质的化学式是
C
2H
6O.故填:C
2H
6O.
分析:(1)该物质与参加反应的氧气的质量之和等于生成的二氧化碳和水的质量之和;
(2)通过计算可以判断物质的元素组成及其元素质量;
(3)用元素符号和相应的数字可以表示物质的化学式.
点评:本题主要考查质量守恒定律和计算等方面的知识,运用质量分数时注意不要漏掉百分号.

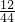 ×100%=2.4g,则氧元素的质量为:8.8g-2.4g=6.4g.
×100%=2.4g,则氧元素的质量为:8.8g-2.4g=6.4g.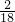 ×100%=0.6g,则氧元素的质量为:5.4g-0.6g=4.8g.
×100%=0.6g,则氧元素的质量为:5.4g-0.6g=4.8g. :
: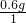 :
: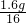 =2:6:1.该物质的化学式是
=2:6:1.该物质的化学式是

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案