
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:初中化学 来源: 题型:阅读理解
 (2013?北京)水是最普通、最常见的物质之一.
(2013?北京)水是最普通、最常见的物质之一.
| ||
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
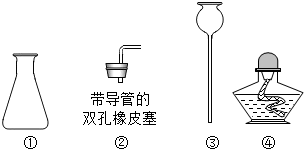
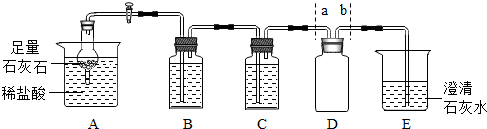
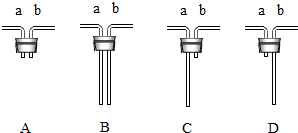
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
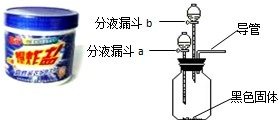 去的多种顽固污渍”.小强同学对这种“污渍爆炸盐”的化学成分非常感兴趣,对其化学成分进行探究.主要探究过程如下:
去的多种顽固污渍”.小强同学对这种“污渍爆炸盐”的化学成分非常感兴趣,对其化学成分进行探究.主要探究过程如下:| 序号 | 主要操作步骤 | 主要实验现象 | 操作目的 |
| ① | 在广口瓶中加入少量 二氧化锰 二氧化锰 (黑色固体);在分液漏斗a中加入新配制的“污渍爆炸盐”的饱和水溶液;在分液漏斗b中加入稀盐酸 稀盐酸 . |
无 无 |
检验溶液中是否含有过氧化氢 检验溶液中是否含有过氧化氢 |
| ② | 打开分液漏斗a的活塞,放出适量溶液后,关闭活塞. | 生成大量无色气体. | 检验过氧化氢分解 检验过氧化氢分解 |
| 然后 用带火星的木条接近导管口 用带火星的木条接近导管口 . |
带火星的木条复燃 带火星的木条复燃 |
验证生成气体的成分 | |
| 第②步操作得到的结论:“污渍爆炸盐”溶于水生成过氧化氢. | |||
| ③ | 待②步反应停止后,打开分液漏斗b的活塞,放出适量溶液后,关闭活塞. | 生成大量无色气体. | 检验碳酸钠和盐酸反应 检验碳酸钠和盐酸反应 |
| 将生成的气体通入 澄清石灰水 澄清石灰水 . |
澄清石灰水变浑浊 澄清石灰水变浑浊 . |
验证生成气体的成分 | |
| 第③步操作得到的结论:“污渍爆炸盐”溶于水生成碳酸钠. | |||
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
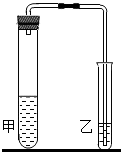 (2012?鼓楼区一模)研究性学习小组对碳酸钠和碳酸氢钠的性质进行探究,请你参与实验.
(2012?鼓楼区一模)研究性学习小组对碳酸钠和碳酸氢钠的性质进行探究,请你参与实验.| 碳酸钠+盐酸 | 碳酸氢钠+盐酸 | |
| 实验现象 | ||
| 化学反应方程式 |
温度 溶解度 |
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com