
【题目】某元素的1个原子失去1个电子后形成的粒子与氖原子(Ne)有相同的核外电子数,下列说法正确的是( )
A.该元素的原子核外有两个电子层
B.该粒子带一个单位的负电荷
C.该粒子核内有10个质子
D.该粒子为Na+
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:初中化学 来源: 题型:
【题目】实验桌上有一瓶无色液体,某同学说可以往溶液样品中滴加石蕊试液,判断其酸碱性。该环节属于科学探究的( )
A. 提出问题 B. 作出猜想 C. 设计实验 D. 反思评价
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组为了测定镁铜合金中镁的质量分数,取出3g合金,将60g稀硫酸分6次加入样品中,充分反应后过滤、洗涤、干燥、称重,得到实验数据如下.
稀硫酸用量 | 剩余固体质量 |
第一次加入10g | mg |
第二次加入10g | 2.0g |
第三次加入10g | 1.5g |
第四次加入10g | 1.0g |
第五次加入10g | 0.6g |
第六次加入10g | 0.6g |
(1)从以上数据可知,最后剩余的0.6g固体的成分是;这六次实验中,第次加入稀硫酸时样品中的镁已经完全反应;表格中,m= .
(2)计算合金样品中镁的质量分数.
(3)计算所用稀硫酸中H2SO4的质量分数.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列叙述错误的是( )
A. 分子、原子和离子都能直接构成物质
B. 原子中原子核与核外电子的电量相等,电性相反,因而原子不显电性
C. 决定原子质量大小的主要是质子和电子
D. 原子如果得到或失去电子就变成离子
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】X、Y、Z三种物质的溶解度曲线如图所示.下列叙述中,正确的是( ) 
A.40℃时Z的溶解度最大
B.温度由60℃降至40℃时,Y析出的晶体最多
C.40℃时,Z和Y的饱和溶液的溶质质量分数相同
D.40℃时,X、Y、Z的饱和溶液升温至60℃,溶质质量分数X=Y>Z
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】盐酸是一种重要的化工产品,也是实验室中重要的化学试剂,用途广泛. 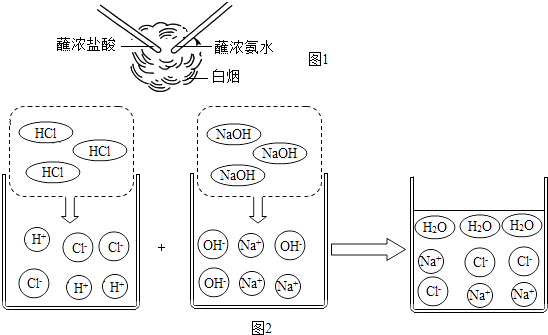
(1)增大压强,HCl由气态为液态,从微观的角度分析该变化过程中改变的是 .
(2)蘸浓盐酸的玻璃棒和蘸浓氨水的玻璃棒接近但不接触,发生了如图1的现象,反应的化学方程式是 , 浓盐酸和浓氨水都具有挥发性,气体有刺激性和腐蚀性,实验时要注意 .
(3)观察图2并回答问题: 由图2可知,HCl和NaOH的反应实质是H+和OH﹣之间的反应,此反应可表示为:H++0H﹣=H2O.像这种用实际参与反应的离子来表示反应的式子称为离子方程式.任何复分解反应都可用离子方程式来表示.
【练习】按照书写化学方程式的要求写出下列反应的离子方程式
HCl溶液与AgNO溶液反应: .
HNO3溶液与Na2CO3溶液反应: .
【归纳】复分解反应的实质是:阴阳离子结合生成的反应.
【应用】判断在水溶液中一定能大量共存的离子组是 .
A.Na+、H+、Cl﹣、CO32﹣ B.H+、Ba2+、Cl﹣、SO42﹣
C.Cu2+、Na+、NO3﹣、OH﹣ D.H+、K+、Cl﹣、SO42﹣ .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】超市卖的纯碱产品中往往含有少量的氯化钠,某化学兴趣小组的同学通过实验来测定某纯碱样品中碳酸钠的质量分数。兴趣小组取15 g 纯碱样品,向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示。请根据题意回答问题:
(1)当滴加稀盐酸至图中A点时,烧杯中溶液里的溶质是。(写化学式)
(2)该纯碱样品中碳酸钠的质量分数是多少? (写出计算步骤,计算结果精确到0.1%)
(3)恰好完全反应时,溶液中溶质的质量为多少?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】既要在一充满空气的瓶子中,将其中的氧气除去.又不增加其他气体的成分.下列物质在瓶中燃烧可达到目的是( )
A.木炭 B.硫磺 C.铁丝 D.红磷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com