
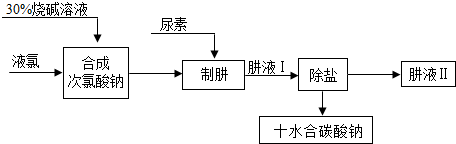
分析 (1)根据配制溶液需要的玻璃仪器考虑;(2)根据方程式的书写和相对分子质量的计算考虑;(3)根据碳酸钠的溶解度随温度变化比较大从溶液中结晶析出的方法:冷却热饱和溶液的方法;(4)根据方程式的写法考虑.
解答 解:(1)配制溶液需要在烧杯内进行,需要用量筒量取水,用玻璃棒搅拌,还用到胶头滴管,所以选择BD;
(2)由Cl2+H2O=HCl+HClO,可知Cl2与NaOH溶液发生反应时,氯气先与水反应,生成的盐酸、次氯酸再与氢氧化钠反应生成氯化钠、次氯酸钠和水,所以反应物是氯气和氢氧化钠,生成物是氯化钠、次氯酸钠和水,用观察法配平即可,所以方程式是:Cl2+2NaOH=NaCl+NaClO+H2O;根据氯气和氢氧化钠反应的方程式可知:投入的液氯与烧碱的质量之比为:35.5×2:2×40=71:80,再根据方程式:CO(NH2)2(尿素)+NaClO+2NaOH=N2H4+Na2CO3+NaCl+H2O,可知还需要氢氧化钠两份质量,所以液氯与烧碱的质量之比为71:160;
(3)碳酸钠的溶解度随温度变化比较大从溶液中结晶析出的方法:冷却热饱和溶液的方法,所以先将溶液加热蒸发,再降温,使晶体析出,再进行过滤,所以步骤为:BED.
(4)肼除氧的反应物是肼和氧气,因为氧化产物无污染所以是氢和氧结合成的水,根据质量守恒定律可知生成物还有氮气,再根据观察法配平,所以方程式是:N2H4+O2=N2+2H2O.
故答案为:(1)BD;(2)Cl2+2NaOH=NaCl+NaClO+H2O;160;(3)BED;(4)N2H4+O2=N2+2H2O.
点评 解答本题关键是要熟悉方程式的书写注意事项,知道配制溶液需要的仪器,溶质从溶液中结晶析出的方法.


科目:初中化学 来源: 题型:解答题
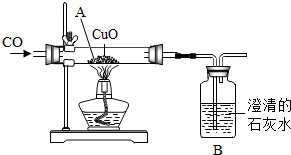 如图为一氧化碳还原氧化铜的装置图.
如图为一氧化碳还原氧化铜的装置图.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
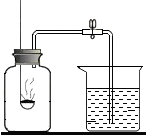 某同学用如图装置测定空气中氧气的体积分数.请你填写有关空格,并与同学交流.
某同学用如图装置测定空气中氧气的体积分数.请你填写有关空格,并与同学交流.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 项目 | 空气污染指数 | 空气质量级别 | 空气质量 |
| 可吸入颗粒 | 65 | Ⅱ | 良 |
| 二氧化硫 | 10 | ||
| 二氧化氮 | 20 |
| A. | 空气质量级别越高,空气质量状况越差 | |
| B. | 露天焚烧垃圾可加剧以上三个项目的污染指数 | |
| C. | 造成空气污染的主要气体是NO2、SO2、CO等 | |
| D. | 可吸入颗粒就是PM2.5 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. |  探究石蜡中是否含有氢元素 | |
| B. | 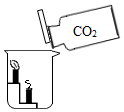 探究二氧化碳的密度比空气大,本身不燃烧且不支持燃烧 | |
| C. | 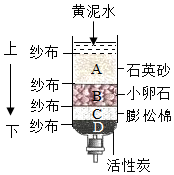 净化黄泥水 | |
| D. | 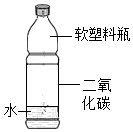 探究CO2能与水发生化学反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
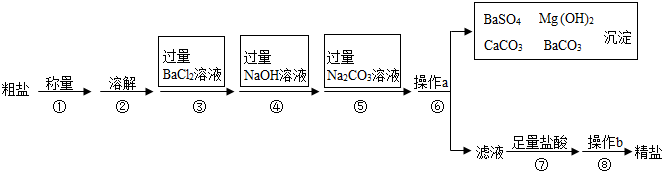
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com