
| 序号 | 加入稀盐酸的质量/g | 剩余固体的质量/g |
| 第1次 | 20 | 16 |
| 第2次 | 20 | 12 |
| 第3次 | 20 | 8.5 |
| 第4次 | 20 | n |
分析 (1)根据表格中的数据可知20g酸能否溶解4g固体,则第3次加酸溶解的固体小于4g,说明氧化铜完全反应,即剩余固体为8.5g;
(2)根据样品的质量和铜的质量来计算氧化铜的质量分数;
(3)根据20g酸能否溶解4g氧化铜固体,利用化学反应方程式计算来计算盐酸中溶质的质量分数.
解答 解:(1)因Cu不与盐酸反应,而氧化铜与盐酸反应,根据20g样品中每加入20g盐酸固体溶解20g-16g=16g-12g=4g,则第3次加入盐酸溶解的质量为12g-8.5g=3.5g<4g,
则8.5g为铜,即第4次加盐酸,也不再反应,则n为8.5,故答案为:8.5;
(2)样品中氧化铜的质量分数为$\frac{20g-8.5g}{20g}$×100%=57.5%,故答案为:57.5%;
(3)由20g酸能溶解4g氧化铜固体,设盐酸中溶质的质量为x,则
CuO+2HCl═CuCl2+H2O
80 73
4g x
$\frac{80}{4g}=\frac{73}{x}$
解得x=3.65g,
则盐酸中溶质的质量分数为$\frac{3.65g}{20g}$×100%=18.25%,
答案:
(1)8.5
(2)57.5%;
(3)盐酸中溶质的质量分数为18.25%.
点评 本题考查学生利用表格中的数据来判断样品中的成分的质量,学生应注意利用物质的性质来分析其发生的反应,并利用化学反应方程式进行简单计算.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 分别将带火星的木条放入两瓶气体中,可比较二氧化碳含量的不同 | |
| B. | 分别将带火星的木条放入两瓶气体中,可比较氧气含量的不同 | |
| C. | 呼出气体中,水蒸气的含量变少 | |
| D. | 呼出气体中,有氮气、氧气、二氧化碳、稀有气体等 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
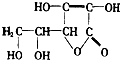 黄瓜中富含维生素C,其分子结构如图.维生素C由三种元素组成.多服用富含维生素C的事物能增强皮肤的弹性,保护大脑,并且有助于人体创伤的愈合,维生素C在pH<5的环境中较稳定,为减少维生素C的损失,黄瓜在烹饪时应加入少量的酸性物质.(填“酸性”、“碱性”或“中性”)
黄瓜中富含维生素C,其分子结构如图.维生素C由三种元素组成.多服用富含维生素C的事物能增强皮肤的弹性,保护大脑,并且有助于人体创伤的愈合,维生素C在pH<5的环境中较稳定,为减少维生素C的损失,黄瓜在烹饪时应加入少量的酸性物质.(填“酸性”、“碱性”或“中性”)查看答案和解析>>
科目:初中化学 来源: 题型:解答题
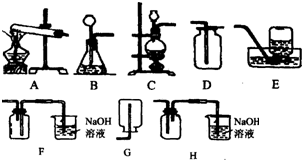
 如图实验装置.请回答以下有关问题:
如图实验装置.请回答以下有关问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com