
| 相对原子质量×原子个数 |
| 相对分子质量 |
| 14×2 |
| 132 |


科目:初中化学 来源: 题型:阅读理解
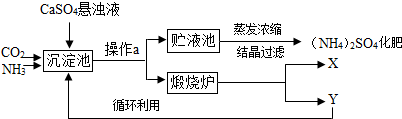
| ||
| 指标 项目 |
优等品 | 合格品 |
| 氮(N)含量 | ≥21.0% | ≥20.5% |
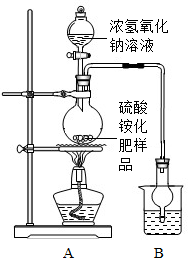
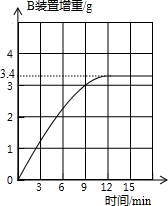
查看答案和解析>>
科目:初中化学 来源: 题型:
| N的相对原子质量×2 |
| (NH2)2SO4的相对分子质量 |
| 14×2 |
| 132 |
| 7.08g |
| 7.5g |
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| 河段编号 | 水质类别 | 主要污染指标 | 质量状况 |
| 甲 | Ⅱ | 良好 | |
| 乙 | Ⅳ | 汞 | 一般 |
| 丙 | 劣Ⅴ | 总磷、氮等 | 较差 |
| 宇宙牌化肥--国际首创 主要成分:尿素[CO(NH2)2] 含氮量居全球化肥之首:48% 净含量:50kg/袋 “宇宙”化肥有限责任公司出品 |
查看答案和解析>>
科目:初中化学 来源: 题型:
硫酸铵的化学式为(NH4)2SO4,
(1)硫酸铵的相对分子质量为____________;
(2)N、H、S、O的原子个数比_______________;
(3)N、H、S、O的质量比____________;
(4)氮元素的质量分数____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com