
【题目】下列叙述正确的是( )

A.为提醒人们在使用浓硫酸时要注意安全,贮存浓硫酸的容器上贴有如图标识
B.实验室可通过蒸馏的方法除去自来水中含有的Cl-等杂质制蒸馏水
C.NH4Cl、(NH4)2SO4 、NH4HCO3、 CO(NH2)2都能与碱性物质反应生成NH3,在使用时都不能与熟石灰一起施用
D.由于碱金属单质钾、钠、钙等化学性质活泼,很容易与空气中氧气反应,故实验室中的各种碱金属单质均保存在水中
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】A、B、C 三种物质溶解度曲线如图所示,下列说法中一定正确的是( )
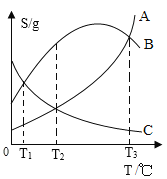
A. T1℃时,等质量的B、C 溶液中溶质质量相同
B. T2℃时,等质量的 A、C 饱和溶液中溶质质量分数相同
C. 将 T3℃等质量的 A、B 溶液分别降温至 T1℃,A溶液析出的晶体质量更大
D. 将 T2℃等质量的A、C饱和溶液分别降温至T1℃后,A溶液中溶剂质量更大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如下图所示,调节杠杆平衡后开始进行实验。
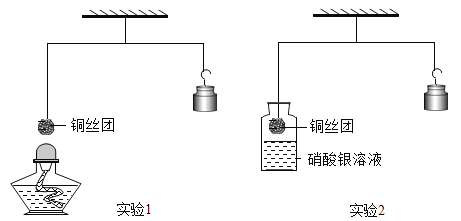
(1)实验1:加热细铜丝团一段时间后移走酒精灯,铜丝变为黑色(CuO),观察到细铜丝团____(填“上升”、“下降”或“不变”),出现上述现象的原因是____。
(2)实验2:将铜丝团浸入硝酸银溶液一段时间,当观察到溶液变为蓝色时小心地松手,发现稳定后的砝码比起始位置____(填高、低、不变),写出瓶中反应的化学方程式___,反应类型属于____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】烧碱具有较好的杀菌消毒作用且廉价易得,但工业烧碱中常含有杂质碳酸钠。某科学学习小组同学围绕工业烧碱样品纯度测定问题,展开了讨论与探究。
(原理思路)利用Na2CO3与稀H2SO4反应产生CO2,通过CO2 质量的测定,确定样品中碳酸钠的质量,从而计算样品纯度。
(实验方案)小华同学根据以上思路,设计了如图的实验方案(固定装置省略)。如何检验A装置的气密性________________________。
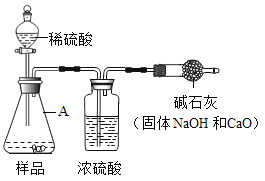
(交流讨论)小明认为上图实验方案的设计有缺陷,会导致难以避免的误差。你认为下列哪些因素会导致实验结果偏高_____________(填序号)。
①加入的稀硫酸量不足 ②装置内空气中的CO2没有排出
③反应产生的CO2未被完全吸收 ④干燥管与空气直接相通
(方案改进)为减少误差,使CO2质量的测定更准确,该小组同学根据以上讨论,对上图方案进行改进,设计了如下图的实验方案(固定装置省略)。
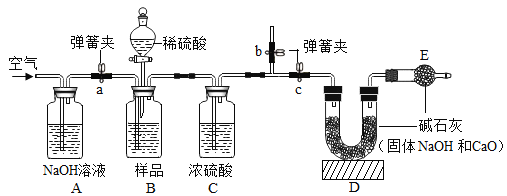
(1)装置B中样品在与稀硫酸反应前和停止反应后,都要通过量的空气。反应前通空气时a、b、c三个弹簧夹的控制方法是_______________。停止反应后,通过量的空气的目的是__________。
(2)写出装置A中发生反应的化学方程式:_______________________。
(数据分析)
(3)若反应过程中,装置B中滴加稀硫酸的速度太快,则烧碱的纯度将____________(填“偏高”、“偏低”或“无影响”)。
(4)若原样品共Ag,实验结束测得C装置增重Bg,D装置增重Cg,则原样品的纯度(质量分数)为_____________________________________。
(拓展延伸)
(5)D装置用装有氢氧化钠固体的U形管,而不用装有澄清石灰水的洗气瓶的原因:_________;请写出CO2与澄清石灰水反应的化学方程式:_______________________。
(6)实验结束后,小华、小明一起探讨时,发现按目前所学知识还有其它实验方案测定工业烧碱样品纯度,请你帮他们设计一个新方案:____________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】业上生产电路板及处理废液的工艺流程如下:
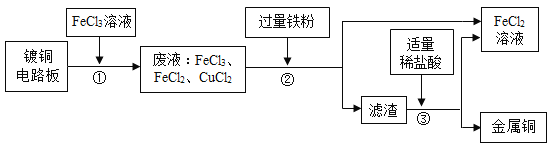
(1)由步骤①可判断FeCl3与铜反应生成的两种产物是________和________。
(2)步骤②加入过量的铁粉,除能与废液中CuCl2反应外,还可发生反应的化学方程式为_______。该反应的基本类型是:_______反应。
(3)步骤③加入稀盐酸,充分搅拌,当观察到_______________现象时,说明滤渣只剩铜。
(4)步骤②③所得FeCl2可与一种单质发生化合反应生成FeCl3,实现循环使用。根据质量守恒定律可推测该单质的化学式为Cl2,已知Cl2与H2O反应的化学方程式为:Cl2+H2O =HCl +HClO,则Cl2与氢氧化钙溶液反应的化学方程式为:__________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
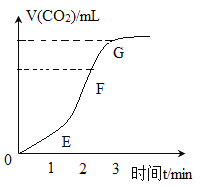
(1)实验过程如图所示,分析判断:_____段化学反应速率最快,FG段反应速率发生变化的主要原因是_____。
(2)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是_____
A蒸馏水 B氯化钠固体 C氯化钠溶液 D浓盐酸
(3)除了上述方法外,你认为还可以采取哪些措施来减缓化学反应速率?_____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】人类的生活和生产都离不开金属,铁是世界产量最高且应用最广泛的金属。
(1)生活中用铁锅作炊具,是利用了铁的____性;
(2)铁制品生锈的主要条件是铁与____直接接触,铁锈的主要成分是____(填化学式);防止铁生锈的方法有____(答一种即可)。
(3)Pb的化合价有+2和+4价,Pb3O4属氧化物,也属于盐,其盐的化学式可表示为Pb2(PbO4),铁的氧化物Fe3O4也属于盐,则其盐的化学式可表示为____;
(4)取某钢样粉末50.0 g(假设只含Fe和C),在氧气流中充分反应,将产生的气体通入足量的澄清石灰水中,得到2.5 g白色沉淀。另取三份不同质量的该钢样粉末分别加入到100.0 g质量分数相同的稀H2SO4中,充分反应后,测得的实验数据如下表所示:
实验序号 | 甲 | 乙 | 丙 |
加入钢样粉末的质量(g) | 10.0 | 20.0 | 40.0 |
生成气体的质量(g) | 0.355 | 0.71 | 1.0 |
①根据表中数据可计算出稀硫酸中H2SO4的质量分数为____;
②若要使实验甲中的剩余硫酸全部消耗完,则至少需要再加入____g钢样粉末。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)新时代,要树立和践行“绿水青山就是金山银山”的发展理念。目前,我国已开发和利用的新能源有______(合理即可)。近年来,有些城市部分汽车的燃料改为压缩天然气,天然气的主要成分是甲烷,甲烷燃烧的化学方程式为________。
(2)在一定条件下,A和B两种物质发生反应生成C和D.如图为该反应的微观示意图。
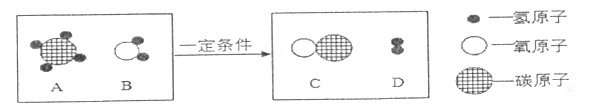
①从微观角度分析该反应的实质是______。
②该反应中,生成C和D的质量比是______。
(3)在托盘天平(灵敏度极高)两边各放盛有等质量、等质量分数足量稀硫酸的烧杯,天平平衡。向左烧杯中加入一定质量的金属M,同时向右烧杯中加入相同质量的金属N,观察到从反应开始至结束天平指针始终偏向右边(注:反应中都生成+2价的硫酸盐)则:
①M、N两种金属的活动性由强到弱的顺序为______。
②M、N两种金属的相对原子质量由大到小的顺序为______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知红色固体 Cu2O 可与稀酸反应生成![]() 和 Cu 。木炭粉加热还原CuO 粉末后得到黑色粉末和红色固体的混合物。下列有关说法正确的是( )
和 Cu 。木炭粉加热还原CuO 粉末后得到黑色粉末和红色固体的混合物。下列有关说法正确的是( )
A.若要除去混在 CuO 中的炭粉可在蒸发皿中高温灼烧
B.将混合物加入足量稀硫酸中,若有黑色粉末剩余,则炭粉一定过量
C.将混合物加入足量稀硫酸中,若溶液变蓝,则CuO 一定过量
D.将混合物加入足量稀硫酸中,若既有红色固体,溶液又变蓝,则生成物中一定有 Cu2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com