
【题目】如图是某饮料标签中的部分成分,请回答下列问题:

(1)打开瓶盖时,通常有大量气泡冒出来,原因是_____,微热该汽水也能产生大量气泡,原因是 _______(写化学方程式)。
(2)白砂糖在人体内催化剂作用下可转化为葡萄糖(C6H12O6),葡萄糖可以发生如下反应:C6H12O6![]() 2X+2CO2
2X+2CO2![]() ,则X的化学式为__________。
,则X的化学式为__________。
【答案】压强减小,气体的溶解度减小 H2CO3![]() H2O+CO2↑ C2H6O
H2O+CO2↑ C2H6O
【解析】
(1)打开瓶盖时,通常有大量气泡冒出来是因为打开瓶盖后,瓶内压强迅速减小,瓶内气体的溶解度随之减小,不能溶解的气体从瓶中挥发形成气泡,故填压强减小,气体的溶解度减小;
微热该汽水也能产生大量气泡是瓶中的碳酸受热分解生成二氧化碳和水,故反应的化学方程式写为:H2CO3![]() H2O+CO2↑。
H2O+CO2↑。
(2)由化学方程式可知,反应前有6个碳原子,12个氢原子和6个氧原子,反应后有2个碳原子和4个氧原子,根据质量守恒定律,尚缺的4个碳原子,12个氢原子和2个氧原子存在于2X中,则X的化学式为C2H6O,故填C2H6O。


科目:初中化学 来源: 题型:
【题目】碳还原氧化铜的实验如图所示,实验结束时停止加热,冷却至室温。相关分析正确的是
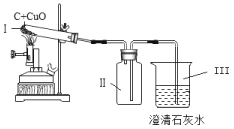
A. 装置 III 中出现气泡,说明 I 中反应已开始
B. 反应中,装置 I 内壁出现水雾是反应生成的
C. 冷却后,装置 I 减少的固体质量等于生成气体的质量
D. 装置 II 中可收集到一瓶二氧化碳气体
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】资料:白磷着火点为40 ℃,红磷的着火点为240 ℃,五氧化二磷能污染空气,五氧化二磷易溶于水。
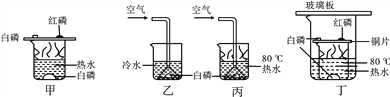
(1)在探究可燃物燃烧条件的课堂上,老师利用图甲所示进行实验。实验时观察到的现象是:____;
(2)小明同学设计了乙、丙2个对比实验,完成了探究过程,得到以下实验事实:①不通空气时,冷水中的白磷不燃烧;②通入空气时,冷水中的白磷不燃烧;③不通入空气时,热水中的白磷不能燃烧;④通入空气时,热水中的白磷燃烧。该实验中,能证明可燃物的温度必须达到着火点才能燃烧的事实是___(填序号,下同);能证明可燃物通常需要接触空气才能燃烧的实验事实是____。
(3)结合老师与小明设计的实验,小强设计了实验装置丁,小明与小强的实验都比老师的实验有个明显的优点,这个优点是____。
(4)根据以上事实你认为白磷在实验室应如何保存____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图为实验室常用的一些实验装置
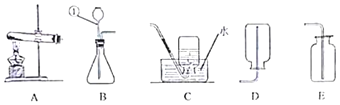
回答下列问题:
(1)写出带标号仪器①的名称:______;
(2)写出锌和稀硫酸反应的化学方程式:______;
(3)实验室收集CO2气体的装置是:______;
(4)通常状况下,NH3为无色、密度小于空气且极易溶于水的气体。实验室制取NH3的原理为:将氢氧化钙与氯化铵两种固体混合物进行加热生成物为:氯化钙、氨气和水,根据以上的信息,写出实验室制取氨气的化学方程式:______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列微粒符号中,对“2”含义的理解正确的是( )
A. 2Cu中的“2”表示2个铜元素
B. ![]() 中的“2”表示每个亚铁离子带有2个单位的正电荷
中的“2”表示每个亚铁离子带有2个单位的正电荷
C. ![]() 中的“2”表示1个硫化氢分子中含有2个硫原子
中的“2”表示1个硫化氢分子中含有2个硫原子
D. ![]() 中化学式上方的“2”表示硫元素为
中化学式上方的“2”表示硫元素为![]() 价
价
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】茶叶中含有茶氨酸(C7H14O3N2),它有降低血压、提高记忆力、保护神经细胞、减肥等效果。回答问题:
(1)茶氨酸分子中碳、氢、氧、氮的原子个数比为 __________。
(2)茶氨酸中碳元素与氮元素质量比为____________。
(3)__________g茶氨酸中含有16g氧元素。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图示意的是教材上的三个实验,请回答:

(1)甲实验黄铜片和铜片互相刻画,出现划痕的是_________(填“黄铜片”或“铜片”)。
(2)乙实验中,左边试管内是铜丝放入硝酸银溶液中,反应的化学方程式是_______。右边试管内是铝丝放入硫酸铜溶液中,实验现象是________。
通过两个实验得到关于金属活动性顺序的结论是_________。
(3)丙是用水稀释浓硫酸的实验,盛放水的仪器叫________,玻璃棒不断搅拌的目的是______,证明硫酸溶于水的现象是______(填序号)。
A.放热 B.浓硫酸落于烧杯底部 C.最终得到均一的无色液体
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】空气质量与氮氧化物有着密切的关系。一氧化氮和二氧化氮是两种重要的氮氧化物。一氧化氮(化学式为NO)是一种无色气体,熔点-163.6℃,沸点151℃,密度比空气略大,微溶于水。NO不稳定,易于空气中氧气发生反应,生成红棕色有刺激性气味的二氧化氮(NO2)。实验室用铜与稀硝酸反应来制备NO.工业上可用氨气与氧气为原料,在加热和催化剂条件下制得一氧化氮。汽车尾气(含有CO与NO等物质)是城市空气的污染源,治理的方法之一是在汽车的排气管上装一个“催化转换器”,使CO与NO反应,生成两种可参与大气生态环境循环的无毒气体。NO被发现广泛分布于生物体内各组织中。1992年被美国Science杂志评选为“明星分子”。NO在心、脑血管调节等方面有着十分重要的生物学作用,是心脑血管的保护神。
依据文章内容,请回答下列问题:
(1)NO的物理性质______。
(2)NO在空气一种会转变成______。
(3)NO可用______法收集。
(4)治理NO的化学方程式为______。
(5)NO对人类有利的一面主要体现在______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图为实验室常用的一些实验装置

回答下列问题:
(1)写出带标号仪器①的名称:______;
(2)写出锌和稀硫酸反应的化学方程式:______;
(3)实验室收集CO2气体的装置是:______;
(4)通常状况下,NH3为无色、密度小于空气且极易溶于水的气体。实验室制取NH3的原理为:将氢氧化钙与氯化铵两种固体混合物进行加热生成物为:氯化钙、氨气和水,根据以上的信息,写出实验室制取氨气的化学方程式:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com