
【题目】氰氨基化钙(CaCN2)是一种重要的化工原料,制备CaCN2的化学方程式为CaCO3+2X=CaCN2+CO↑+H2↑+CO2↑.该反应中下列说法正确的是( )
A. 可用氢氧化钠溶液处理有害的气体产物B. 反应后气体质量减少
C. X的化学式为HCNOD. X溶液的![]()
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】甲、乙两种固体的溶解度曲线如图所示,相关分析正确的是
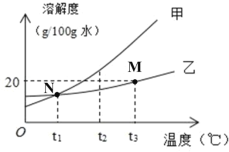
A. M点表示t3℃时,乙饱和溶液溶质质量分数为20%
B. N点表示t1℃时,甲和乙的饱和溶液溶质质量分数相同
C. t2℃时,甲、乙饱和溶液降低温度,甲先析出晶体
D. t3℃时,溶剂质量均为100g的甲、乙饱和溶液降温至t1℃,乙溶液析出的固体更多
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请根据如图所示的实验装置图回答问题:
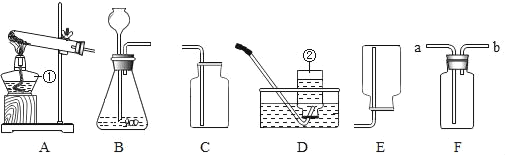
①写出仪器②的名称_____。
②在实验室用C可以收集氧气,收集好的氧气必须正放在试验台上,其依据是_____。我们也可以用D装置收集氧气,依据是_____。
③若用B装置制取二氧化碳,反应原理是_____。
④甲烷是密度小于空气、难溶于水的气体,实验室用加热无水醋酸钠和碱石灰的固体混合物制取甲烷。制取甲烷的发生装置应选择_____(填装置编号,下同),若选用F装置收集甲烷,则气体应从_____通入。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某废旧金属中含有铜、金(Au)和镍(Ni),回收 Au 并制备 CuSO45H2O 晶体的流程如下:
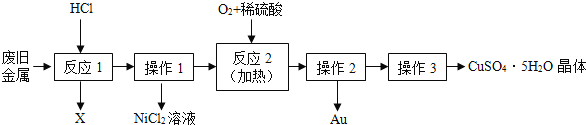
(1)操作1和操作2都用到的玻璃仪器为_____、烧杯和玻璃棒。
(2)反应2的化学方程式为:2Cu+O2+2H2SO4![]() 2_____+2H2O。
2_____+2H2O。
(3)操作3是指蒸发浓缩、_____结晶、过滤等。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳酸亚铁(FeCO3)是制取补血剂的原料,以下是用黄铜矿废液[溶质成份为Fe2(SO4)3、CuSO4及H2SO4]为原料,制备碳酸亚铁并回收铜的生产流程示意图:
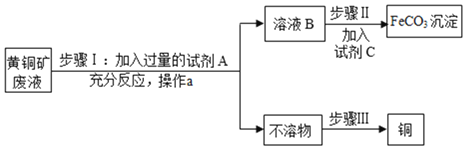
已知:①Fe与Fe2(SO4)3溶液能发生反应生成FeSO4②溶液B中只有一种溶质。
(1)步骤1中,试剂A为______,加入过量A的目的是使废液中Fe2(SO4)3、CuSO4及H2SO4全部转化为______;反应过程中观察到的现象之一是有红色固体析出,写出该反应的化学方程式______。
(2)操作a的名称:______。
(3)步骤Ⅱ中,试剂C的化学式可能为______等可溶性碳酸盐。
(4)步骤Ⅲ的目的是:除去“不溶物”中的另一种金属,回收得到纯净、干燥的铜。用化学方法回收铜的操作步骤为:加入过量的稀盐酸等酸、过滤、洗涤、干燥;回收铜的物理方法为吸铁______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图1是以石灰石为原料制备高纯超细碳酸钙的工艺流程图:

(1)流程中操作A的名称_____。实验室里该操作用到的玻璃仪器有烧杯、_____和_____。
(2)主要反应原理:
①“煅烧”步骤:主要反应的化学方程式为_____,反应基本类型为_____反应。
②“浸出”步骤:CaO+2NH4Cl=CaCl2+H2O+2NH3↑。
③“碳化”步骤:CO2+2NH3+H2O+CaCl2=CaCO3↓+2 NH4Cl。
(3)煅烧石灰石得到的固体中,除含CaO外,还含有少量MgO、FeO等杂质,在“浸出”过程为保证铁、镁等杂质不被浸出,需要适当提高溶液的pH.根据反应②计算出的钙铵比(参加反应的氧化钙和氯化铵的质量比)为_____,而实际流程中最佳钙铵比要稍高于这一比值,原因是_____。
(4)用上述流程可循环使用的物质除了H2O、CO2和NH3之外,还有_____。
(5)实验室在如图2装置中模拟上述流程制备高纯超细碳酸钙:

①搅拌的作用是_____。
②制备CaCl2溶液时需要对装置加热,主要作用是_____。
A 加快反应速率 B 促进氨气逸出
③已知在常温和一个标准大气压下,CO2和NH3在100g水中分别能溶解0.169g和52.9g。制备CaCO3时应先通入氨气后通入二氧化碳,理由是_____。
④浸取一步中NH4Cl溶液的溶质质量分数直接影响着生成CaCl2溶液溶质质量分数。已知0﹣100℃时NH4Cl的溶解度如下表:
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
溶解(g) | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 | 77.3 |
如果用200g 80℃时NH4Cl的饱和溶液与纯氧化钙恰好完全反应,计算充分反应后得到CaCl2的质量_____。(写出计算过程,保留一位小数。)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】能源是关系国家生存和发展的重要的自然资源,今年某些国家在我国南海多次挑起事端,不断掠夺我国南海丰富的自然资源,在南海海底就蕴藏丰富的天然气和石油,与天然气和石油并称为三大化石燃料的是,它们都是属于___(填可再生或不可再生)能源,其中天然气的主要成分为___(填物质的化学式).由于化石能源有限,所以有必要开发新的燃料,乙醇就是一种新的燃料.写出乙醇燃烧的化学方程式:___.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】写出符合要求的化学用语:
(1)镁离子结构示意图_____;
(2)氦气_____;
(3)硫酸铜_____;
(4)标出二氧化碳中碳元素的化合价_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】溶解度可表示物质溶解性的大小
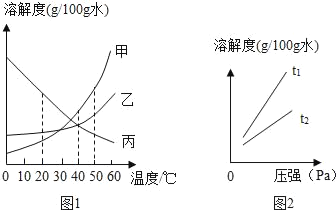
①如图1是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线
Ⅰ.20℃时,甲的溶解度_____(填“>”、“<”或“=”)乙的溶解度。
Ⅱ.40℃时,乙和丙_____(填“能”或“不能”)形成溶质质量分数相同的饱和溶液。
Ⅲ.20℃时,烧杯中分别盛有相同质量甲、乙、丙的饱和溶液,各加入等质量的对应固体,并升温至50℃.请填写下表。
烧杯中的溶质 | 烧杯中固体的变化 |
甲 | _____ |
乙 | 固体逐渐减少至全部溶解 |
丙 | _____ |
Ⅳ.若分别将100g乙、丙的饱和溶液从50℃降温到40℃,对所得溶液的叙述正确的_____(填序号)。
A 乙、丙都是饱和溶液 B 所含溶剂质量:乙<丙
C 溶液质量:乙>丙 D 溶质质量分数:乙>丙
②气体的溶解度也有一定的变化规律。
Ⅰ.打开可乐瓶,逸出大量气泡.由此可见,压强越小,CO2的溶解度越_____.为增大CO2的溶解度,可采用的一种方法是_____。
Ⅱ.不同温度下,氧气的溶解度随压强的变化如图2所示,图中t1对应的温度为40℃,则t2对应的温度_____(填编号)。
a 小于40℃ b 大于40℃ c 无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com