
����Ŀ����һ�������ϵ��й�֪ʶ
��1������ʹ�ý����Ⱥ����ˡ���ͭ������������ʱ�����������ſ�ʼ����ʹ�������ϣ���Ҳ��ӳ��Cu��Fe��Al���ֽ����Ļ����ǿ������˳����_____��
��2��������ʱ�ھ��С����������Ϊͭ��֮˵���û�ѧ����ʽ��ʾ��ԭ��_____��
��3������¶���ڿ����������⣬д��һ�ַ�ֹ��������ķ���_____��
������ͬѧ������ijɷ֡������Ʋ����������弰�������������ȷֽ���о���
�����������������Ʋ����������壨FeC2O4��nH2O��
���ϣ���FeSO4����������������ת��ΪFe2(SO4)3��
��FeSO4���ܽ�����±���
�¶�/�� | 0 | 10 | 30 | 50 | 60 | 70 | 80 | 90 |
�ܽ��/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.3 | 33.0 | 30.5 | 27.0 |
���Ʊ����̣�
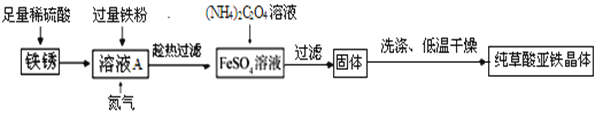
��1����Һ����������ۣ������ķ�Ӧ�У�Fe+Fe2(SO4)3=3FeSO4��_____����ַ�Ӧ��Ҫ���ȹ��˵�Ŀ����_____��
��2�������в��������������巴Ӧ�Ļ�ѧ����ʽΪ_____��
��3���Ʊ������У���Һ��ͨ�뵪����������_____��
������̽��FeC2O4��nH2O�ȷֽ�IJ��Pn��ֵ
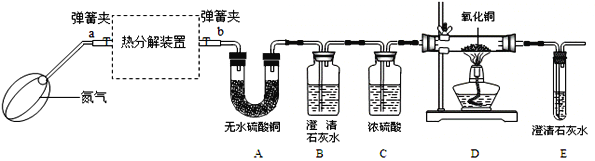
��ʵ��װ�ã�
����:��FeC2O4��nH2OΪ����ɫ��ĩ��FeO��Fe3O4���Ǻ�ɫ���壬����FeO�ױ�����������
��FeC2O4��nH2O������300����ȫʧȥ�ᾧˮ������������400����ʣ��������ȷֽ������ɫ���塢CO2��CO��
��ʵ�������
��1����ͨ��Eװ���г���ʯ��ˮ�������֤���������������ȷֽ����CO��������B��Cװ��֮������ʢ��_____�����Լ����ƣ���ϴ��ƿ��
��2���ȹ��뵪�����ټ��ȷֽ�װ�õ�ԭ����_____��
��3��ָ������ʵ��װ�ò���֮��_____��
��4��ȡ3.60gFeC2O4��nH2O��������ʵ�鲽�����ʵ�飬����ȷֽ�װ���й����������¶ȱ仯��������ͼ��ʾ��
��FeC2O4��nH2O��n��ֵΪ_____��
�ڷ�Ӧ���ȷֽ�װ���в����ĺ�ɫ����Ϊ_____���ѧʽ����
�۲��������������ȷֽ�ķ���ʽΪ_____��
������ͼ��1.44g�����ڿ����г�ּ��ȣ���������0.16g���˹���(����������)Ϊ_____��
���𰸡�Al��Fe��Cu Fe+CuSO4====Cu+FeSO4 ˢ�ᡢͿ�͵� Fe+H2SO4=FeSO4+H2�� ��ֹFeSO4��ᾧ�������ʧ (NH4)2C2O4+FeSO4=FeC2O4��+(NH4)2SO4
��nH2O+(NH4)2C2O4+FeSO4=FeC2O4.��nH2O��+(NH4)2SO4 ��ֹFeSO4������Fe2(SO4)3 ����������Һ �ų�װ����ԭ�����壬��ֹ��������(�����𰸾��ɣ� û�н���β������ 2 FeO FeC2O42H2O![]() FeO+CO��+CO2��+2H2O Fe2O3
FeO+CO��+CO2��+2H2O Fe2O3
��������
��һ����1������ʹ�ý���Խ�磬˵���ý���Խ�����ã�������ֽ����Ļ����ǿ������˳����Al��Fe��Cu��
��2��������ʱ�ھ��С����������Ϊͭ��֮˵����ԭ������������ͭ��Ӧ��������������ͭ����Ӧ�Ļ�ѧ����ʽΪ��Fe+CuSO4�TCu+FeSO4��
��3������¶���ڿ����������⣬ˢ�ᡢͿ�͵ȿ��Է�ֹ�������⣻
��������1����Һ����������ۣ�������������Ӧ�������������������ᷴӦ����������������������Ӧ�Ļ�ѧ����ʽΪ��Fe+Fe2��SO4��3��3FeSO4��Fe+H2SO4�TFeSO4+H2������ַ�Ӧ��Ҫ���ȹ��˵�Ŀ���ǣ���ֹFeSO4��ᾧ�������ʧ��
��2�������в��������������巴Ӧ�Ļ�ѧ����ʽΪ��(NH4)2C2O4+FeSO4=FeC2O4��+(NH4)2SO4��NH4��2C2O4+FeSO4+nH2O��FeC2O4nH2O��+��NH4��2SO4��
��3���Ʊ������У���Һ��ͨ�뵪���������Ƿ�ֹFeSO4������Fe2��SO4��3��
��������1����ͨ��Eװ���г���ʯ��ˮ�������֤���������������ȷֽ������CO��������C��Dװ��֮������ʢ������������Һ��ϴ��ƿ�������ն�����̼���壻
��2���ȹ��뵪�����ټ��ȷֽ�װ�õ�ԭ���ǣ��ų�װ����ԭ�����壬��ֹ�������ţ�
��3������ʵ��װ�ò���֮���ǣ�û�н���β���������ᵼ��һ����̼��ɢ����������Ⱦ������
��4���ٽᾧˮ����Ϊ��3.60g��2.88g��0.72g
����������144��18n��2.88g��0.72g
n��2
��3.60g��������Ԫ������Ϊ��3.60g��![]() ��1.12g
��1.12g
��Ӧ���ȷֽ�װ���в����ĺ�ɫ��������ԭ�Ӻ���ԭ�Ӹ�����Ϊ![]() ��
��![]() ��1��1�����ȷֽ�װ���в����ĺ�ɫ������������������ѧʽΪ��FeO��
��1��1�����ȷֽ�װ���в����ĺ�ɫ������������������ѧʽΪ��FeO��
�۲��������������ȷֽ���������������������̼��һ����̼��ˮ����Ӧ�Ļ�ѧ����ʽΪ��FeC2O42H2O![]() FeO+CO��+CO2��+2H2O��
FeO+CO��+CO2��+2H2O��
������ͼ��1.44g�����ڿ����г�ּ��ȣ���������0.16g��˵���μӷ�Ӧ����������Ϊ0.16g��
�˹��壨�������������ԭ�Ӻ���ԭ�Ӹ�����Ϊ![]() ��
��![]() ��2��3����������������������������
��2��3����������������������������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ��������п�����ֱ�͵��������ᷴӦ����������������ʱ��Ĺ�ϵ��ͼ��ʾ������˵������ȷ���ǣ� ��
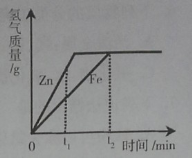
A��t1ʱ����������������п������
B��t1ʱ����������������п������
C��t2ʱ���μӷ�Ӧп������������ͬ
D��t2ʱ��п�������ĵ�����������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����5�֣��ס��ҡ������ֹ���������ˮ�е��ܽ��������ͼ��ʾ����ش�

��1��ͼ��P���������
��2�������л����������ң���ò��� �ķ����ᴿ��
��3��ʹ30���ӽ����͵ļ���Һ��ɸ��¶��µı�����Һ���ɲ��õ� һ�ַ�����
��4��ʹ50���ס��ҡ����������ʵı�����Һ���µ�10���������������������������
��5����100g 50����ˮ�м���65g���壬����ȫ���ܽ⣬һ��ʱ������в��ּľ�������������Ϊ��ȫ���ܽ⡱��ԭ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ij����β������װ���з�����Ӧ����ʾ��ͼ������˵����ȷ���ǣ� ��
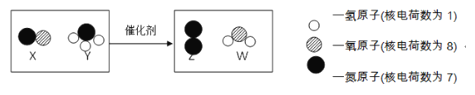
A. �÷�Ӧ�У�Z����Y�ֽ����ɵ�
B. X.Y.Z���ɷ��ӹ���
C. ��ѧ��Ӧǰ����������������һ������
D. �μӷ�Ӧ��X�����ɵ�Z��������Ϊ9:7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС���ͬѧΪ�˲ⶨij�������Ĵ����Ƿ������ŵ�Ʒ(���ҹ涨���ŵ�Ʒ��̼���Ƶ���������������99.2%)�������������ʵ�鷽����
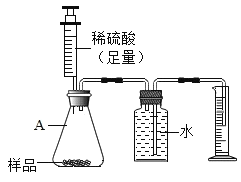
(1)����һ����ȡ��Ʒ10.65g,��ˮ��ȫ�ܽ�,�����м����������Ȼ�����Һ,��ַ�Ӧ��,���ˡ�ϴ�ӡ�����ù���19.70g.ͨ������(д���������)______�жϸó��IJ�Ʒ�Ƿ������ŵ�Ʒ.(���ʿ�����ˮ�Ҳ����Ȼ�����Ӧ)
(2)������������ͼ��ʾ��װ��,ͨ��ȷ�����ų�ˮ�����,Ҳ�ɼ�����Ʒ�Ĵ��ȡ���װ������ʹ��ע�������ŵ���__________,��ʵ���ͬѧ�Ƿ��������̼���ƵĴ���ƫ��,��ɴ˽����ԭ�������______________.(װ������������)��дһ�����ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��20 ��ʱ��ȡ18 g KNO3��18 g NaCl�ֱ������ֻ�ձ��У�������50 mLˮ(ˮ���ܶ�Ϊ1 g/mL)������ܽ⣬������ͼ����ʾ�����µ�50 ��ʱ��������ͼ����ʾ��KNO3��NaCl���ܽ��������ͼ������ش��������⣺
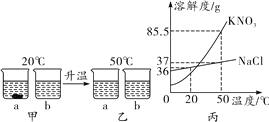
(1)a�ձ��м����������______(�ѧʽ)��
(2)��ͼ�У�a�ձ���Һ�����ʵ���������______(������������������)b�ձ���Һ�����ʵ�����������
(3)Ҫʹ��ͼ�е�NaCl��Һǡ�ñ�ɱ�����Һ����Ҫ����________g NaCl���塣
(4)��ȥNaCl�����л��е�����KNO3��ʵ�鲽�裺�ȼ�ˮ�ܽ⣬��________��Ȼ����ˡ�ϴ�ӡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС��Բ��ֱ��ʵ��������ƹ�������ᴿ���������ͼ�������̣���ش�
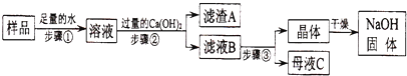
��1����������Ӧ�Ļ�ѧ����ʽΪ________���������Ca��OH��2��Ŀ����________
��2����ҺB�е�������________��________��д��ѧʽ�����������������ľ�������Ǽ���Ũ����________�����ˣ�
��3��̽������NaOH������̼���Ƶ�����������
�����ʵ�飩����ͬѧ����ȡ20.0g��Ʒ������������������������Ϊ14.6%��ϡ����ֱ����Ӧֹͣ�����ռ���4.40g������̼��
����ͬѧ����ȡ20.0g��Ʒ����ˮ�����Һ������Һ�м�������ij���ʯ��ˮ�����ˡ�ϴ�ӡ�������õ���ɫ����10.0g��
��������⣩
��������ͬѧ��ʵ����������������Ǽ������Ʒ��̼���Ƶ�����������________������д��������� Ca��40 C��12O��16H��1Na��23��
��4���������뷴˼��
�ڽ���ʱ����ʦ��ͬѧ�����ܷ�������ʵ�����õ����ݼ������Ʒ���������Ƶ����������������������ͬѧ��һ����Ϊ���ԣ���С��˼�����üס������ַ��������ף������ǣ�________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��a��b��c �������ʵ��ܽ����������ͼ��ʾ��ȡ������![]() ���� a��b��c �������ʵı�����Һ���ֱ���������ˮ��ָ���
���� a��b��c �������ʵı�����Һ���ֱ���������ˮ��ָ���![]() ��������˵������ȷ����
��������˵������ȷ����
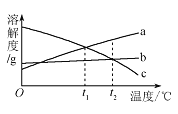
A. ԭ������Һ�У����ʵ��������� a>b="c"
B. �ָ��� t2��ʱ���������ʵ����� a>b=c
C. �ָ���t2��ʱ��������Һһ�����DZ�����Һ
D. ������������ t1����������Һһ�����DZ�����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ���ڷֱ�ʢ�� 100g ˮ���ձ��з��� KNO3 ����ܽ⣬��˵����ȷ����
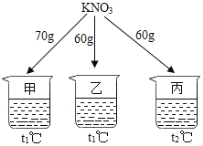
�¶ȣ����� | t1 | t2 |
KNO3���ܽ�ȣ�g/100g ˮ�� | 60 | 90 |
A. �ס��һ�Ϻ�Ϊt1��IJ�������Һ
B. ��������t2�棬��Һ��������
C. �ҡ�����Һ�������������
D. ��������t1�棬�о�������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com