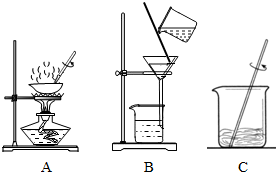
解:粗盐提纯的主要步骤,
①溶解,将粗盐逐渐加入盛有水的烧杯里,边加边用玻璃棒搅拌(玻璃棒的作用是搅拌,加速溶解),直加到粗盐不再溶解时为止,观察所得食盐水是否浑浊;
②过滤,过滤食盐水,仔细观察滤纸上剩余物及滤液颜色,如滤液浑浊,应再过滤一次;
③蒸发,把所得滤液倒入蒸发皿,用酒精灯加热,待蒸发皿中出现较多固体时,停止加热,利用余热蒸干.
图中A是蒸发,B是过滤,C是溶解;B过滤实验中玻璃棒的作用是引流.蒸发过程中当看到有较多晶体析出时停止加热,利用余热蒸干;
(2)根据精盐的产率计算方法,A中粗盐可能没有及时的全部溶解,这样食盐的质量偏小,所以结果偏低;B中有液体或固体溅出,则造成精盐减少,分子偏小,计算结果偏低;C中未完全干燥就称量,会造成精盐质量增加,里面还有部分水分,使结果偏大.故选AB.
(3)①加入氢氧化钠,镁离子与氢氧根离子结合成氢氧化镁沉淀,加入碳酸钠,钙离子能和碳酸根离子结合成碳酸钙沉淀,加入氯化钡,硫酸根离子与钡离子结合成硫酸钡沉淀,碳酸根离子与过量的钡离子结合成碳酸钡沉淀,故沉淀是
BaSO
4,CaCO
3,Mg(OH)
2.BaCO
3
②碳酸钠要在氯化钡后面加入,如果先加碳酸钠,再加氯化钡,则过量的钡离子不能除去,氢氧化钠与氯化钡谁前谁后都可,故顺序为③①②或①③②;加入盐酸是除去前面加入的过量的氢氧化钠和碳酸钠;
故答案为:(1)CBA,引流; 较多固体(2)AB (3)①BaSO
4,CaCO
3,Mg(OH)
2.BaCO
3
③①②或①③②:除尽溶液中的Ca
2+和Ba
2+;③除去溶液中过量的OH
-和CO
32-.
分析:(1)粗盐提纯是通过溶解把不溶物与食盐初步分离、过滤把不溶物彻底除去、蒸发把食盐从溶液中分离出来而得到食盐的过程;其操作顺序应为溶解-过滤-蒸发.
(2)根据产率=
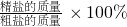
进行分析
(3)根据酸碱盐之间的反应规律分析,除去钙离子、镁离子和硫酸根离子,加入氢氧化钠除去镁离子,加入钡离子除去硫酸根离子,加入碳酸钠除去钙离子和剩余的钡离子,因此碳酸钠要在氯化钡之后加.
点评:本题综合考查了粗盐的提纯及除杂质的方法,明确步骤,会对误差进行分析,除去溶液中的钙离子、镁离子和硫酸根离子添加药品的顺序,注意碳酸钠要在氯化钡之后加,盐酸要在过滤之后的滤液中滴加.

 我们日常生活中,食用的食盐大多来自海水晾晒.海水经蒸发结晶后可获得含有少量泥沙和杂质的粗盐.
我们日常生活中,食用的食盐大多来自海水晾晒.海水经蒸发结晶后可获得含有少量泥沙和杂质的粗盐.
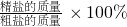 进行分析
进行分析

 (2013?和平区二模)我们日常生活中,食用的食盐大多来自海水晾晒.海水经蒸发结晶后可获得含有少量泥沙和杂质的粗盐.
(2013?和平区二模)我们日常生活中,食用的食盐大多来自海水晾晒.海水经蒸发结晶后可获得含有少量泥沙和杂质的粗盐. (2012?和平区一模)我们日常生活中,食用的食盐大多来自海水晾晒.海水经蒸发结晶后可获得含有少量泥沙和杂质的粗盐.
(2012?和平区一模)我们日常生活中,食用的食盐大多来自海水晾晒.海水经蒸发结晶后可获得含有少量泥沙和杂质的粗盐.

