
【题目】钙被称为人体中的“钢筋混凝土”,
(人体中的钙)
(1)人体缺钙不会导致_______。
A.佝偻病 B.侏儒症 C.骨质疏松
(2)钢筋混凝土属于_________。
A.无机材料 B.合成材料 C.复合材料
(3)人体中钙元素主要存在于骨骼和牙齿中,以羟基磷酸钙[Ca10(PO4)6(OH)2]形式存在,其中磷元素化合价为_____。
(单质钙)
提出问题:钙的化合物很多,为什么我们很少提起单质钙呢?
思考猜想:钙的化学性质活泼。
实验验证一:
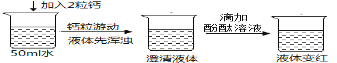
查阅资料:在一个化学反应中,有元素化合价升高,同时就有元素化合价降低。
(4)实验结论: ①写出钙与水反应的化学方程式:_______。②该反应_______热量。(选填“吸收”或“释放”)
(干燥剂中的钙)
提出问题:一包生石灰干燥剂,使用一段时间后可能有哪些固体?
猜想假设:固体中含有氧化钙、氢氧化钙、碳酸钙。
实验验证二:
(5)取固体样品加入水中,若温度明显升高,则含有_______;滴加酚酞后液体变红;继续加足量稀盐酸,如观察到_______,则固体含有碳酸钙。
(6)小明认为无法判断是否有氢氧化钙。理由是:_______。
(7)为了进一步确定固体样品的成分及质量,实验小组利用下图所示的装置(夹持仪器省略)进行实验。
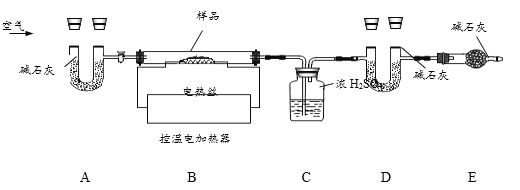
查阅资料:Ca(OH)2加热至580℃、CaCO3加热至825℃分别分解生成两种氧化物。
① 实验前首先要_______,再装入样品。装置A的作用是_______。
② 控温加热使装置B中反应完全,再通一段时间空气,测得反应前后装置C、D分别增重18.0g和22.0g,则固体样品中两种物质的质量比为_______。
③ 装置E的作用是_______。
④ 将装置B中反应后剩余的固体氧化物加入足量水中溶解,蒸发所得固体(不含水)增重36.0g,则原固体样品中CaO的质量为_______g。
【答案】B C +5 Ca + 2H2O = Ca(OH)2+ H2↑ 释放 CaO 有气泡 氧化钙与水反应生成的氢氧化钙溶液也呈碱性 检查装置气密性; 吸收(除去)通入空气中的H2O和CO2 37∶25(或25∶37) 防止外界的H2O和CO2进入装置D中 28
【解析】
(1)人体缺钙会导致佝偻病和骨质疏松,不会导致侏儒症,故选B;
(2)钢筋混凝土属于复合材料,故选C;
(3)钙元素显+2价,氧元素显﹣2价,氢氧根显﹣1价,设:磷元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+2)×10+6x+(﹣2)×4×6+(﹣1)×2=0,则x=+5;
(4)①根据实验现象可知,钙与水反应生成一种能使酚酞试液变红的溶液,结合质量守恒定律可知,该溶液为氢氧化钙溶液,根据“在一个化学反应中,有元素化合价升高,同时就有元素化合价降低”,结合质量守恒定律可知,该反应还应生成氢气。钙与水反应生成氢氧化钙和氢气,化学方程式是Ca+2H2O=Ca(OH)2+H2↑;
②开始时溶液变浑浊,降温后变成澄清溶液,是因为氢氧化钙溶解度随着温度升高而减小,因此该反应属于放热反应;
(5)氧化钙与水反应放出热量。取固体样品加入水中,若温度明显升高,则含有氧化钙;由于生成的氢氧化钙溶液显碱性,因此滴加酚酞后液体变红;碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,继续加足量稀盐酸,如观察到有气泡产生,则固体含有碳酸钙;
(6)氧化钙与水反应生成的氢氧化钙溶液也呈碱性,因此无法判断是否有氢氧化钙;
(7)①为防止装置漏气,影响实验结果,实验前首先要检查装置的气密性,再装入样品;碱石灰中的氢氧化钠和氧化钙能吸收空气中二氧化碳和水。装置A的作用是除去空气中的CO2和H2O,防止它们影响实验结果;
②控温加热使装置B中反应完全,再通一段时间空气,测得反应前后装置C、D分别增重18.0g和22.0g,C中的浓硫酸能吸收水,D中碱石灰能吸收二氧化碳,则氢氧化钙分解生成水的质量为18.0g,碳酸钙分解生成二氧化碳的质量为22.0g;
设:氢氧化钙的质量为x,分解生成的氧化钙的质量为y,碳酸钙的质量为z,分解生成的氧化钙的质量为m。
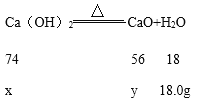
![]() x=74g
x=74g
![]() y=56g
y=56g
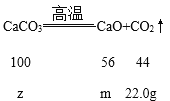
![]() z=50g
z=50g
![]() m=28g
m=28g
则固体样品中两种物质的质量比=74g:50g=37:25(或25∶37);
③装置E是为了防止空气中的二氧化碳和水蒸气进入装置D,影响实验结果;
④将装置B中反应后剩余的固体氧化物加入足量水中溶解,蒸发所得固体(不含水)增重36.0g,设参加反应的氧化钙的质量为n,则

![]() n=112g
n=112g
则原固体样品中CaO的质量为112g﹣56g﹣28g=28g。


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案科目:初中化学 来源: 题型:
【题目】“食盐加碘”通常是在氯化钠中加入碘酸钾。如图是氯化钠和碘酸钾的溶解度曲线图。下列说法错误的是( )
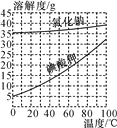
A. 氯化钠易溶于水
B. 碘酸钾的溶解度随温度升高而增大
C. 20 ℃时不可能制得相同质量分数的碘酸钾溶液和氯化钠溶液
D. 20 ℃时两者的饱和溶液,氯化钠的质量分数大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学是在分子、原子的层次上研究物质的性质、组成、结构与变化规律的科学。下图是某化学反应的微观示意图,下列说法正确的是
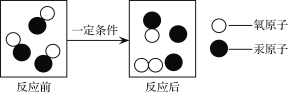
A. 反应前后分子的个数不变 B. 生成物有三种
C. 反应前后汞原子和氧原子的个数不变 D. ![]() 是保持氧气化学性质的最小粒子
是保持氧气化学性质的最小粒子
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室中,利用下列装置可以制取某些气体,请回答下列问题。

(1)写出带标号的仪器的名称:①__________ ;②__________。
(2)向气体发生装置内加入药品前,应该进行的操作是_________。
(3)实验室若用高锰酸钾制取氧气,选择的发生装置是_________;用双氧水制氧气的化学方程式为 _________
(4)乙炔又称电石气,是一种无色、无味、密度比空气略小,不溶于水的气体;工业上常用它燃烧产生的高温来切割和焊接金属;实验室用电石(固体)与水反应制取乙炔。你认为制取乙炔应选择的发生装置是_____________;收集装置是__________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】NaCl是重要的资源,其应用与生产如下图所示。下列说法不正确的是

A. 应用①操作步骤为:计算、称量、溶解
B. 应用②得到NaOH的同时还生成Cl2和H2
C. 应用③之所以发生是因为一定条件下NaHCO3的溶解度较小
D. 生产中提纯粗盐时可依次加入过量的BaCl2、NaOH、Na2CO3溶液,再过滤、蒸发
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】同学们用Na2CO3溶液和浓HCl来研究简易灭火器的反应原理时,对废液的成分进行了探究.
(推理假设)上述两种物质反应的化学方程式为______由此推测出废液中一定有NaCl,可能有Na2CO3或盐酸.
(实验探究)
(一)、确定废液中是否含有盐酸
(1)选择试剂:根据盐酸的化学性质,同学们选用了如图所示的五种物质,其中物质X是酸碱指示剂中的_____溶液.
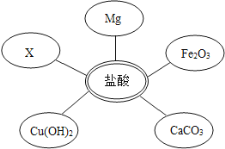
(2)实验验证:某同学向废液中加入少量的镁粉,观察到_____,确定废液中一定没有盐酸.
(二)确定废液中是否含有Na2CO3
(1)某同学选用_____测出废液的pH=10,确定废液中一定含有Na2CO3
(三)处理废液,回收利用
欲从废液中得到纯净的NaCl,设计了如下实验方案,你认为可行的是_____.(选填序号)
A.加入适量的稀盐酸,蒸发结晶
B.加入适量的Ca(OH)2溶液,过滤、蒸发结晶
C.加入过量的氯化钙溶液,过滤、蒸发结晶
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是元素周期表中1~18号元素的相关信息,请认真分析并回答下列问题。
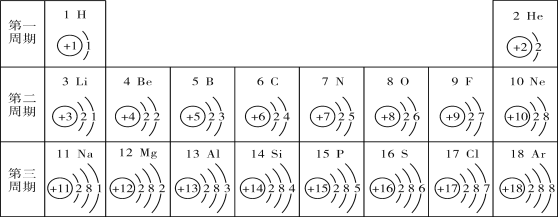
(1)元素周期表是学习和研究化学的重要工具。俄国的化学家_____________发现了元素周期律并编制出元素周期表。
(2)原子序数为5的元素的名称是________,它位于元素周期表中第_________周期。
(3)在化学反应中,原子序数为16的元素的原子容易____________(填“得到”或“失去”)电子,所形成的粒子的符号是________。
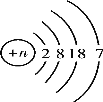
(4)如图是溴元素(Br)的原子结构示意图,那么,其中n为______,分析氟原子和溴原子的结构示意图分析,可以发现:由于氟原子和溴原子的_________________相同,所以它们的化学性质相似;
(5)对1-18号元素的原子结构示意图进行分析,可以发现许多规律,如在同一周期,从左到右,核外电子数依次递增。请再总结出其它规律,并写出其中一条:______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】测定大理石含CaCO3的质量分数,取大理石12.5g,加入盛有100g稀盐酸的烧杯中,两者恰好完全反应(假设其他杂质不与盐酸反应,也不溶解)。烧杯内物质的质量变为108.1g。试计算大理石样品中CaCO3的质量分数_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是某一反应的微观示意图,下列说法正确的是( )
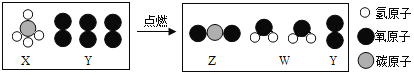
A. 该反应属于分解反应
B. 生成物都是氧化物
C. 氧元素的化合价在反应前后保持不变
D. 化合物Z与W的相对分子质量之比为44:36
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com