10.实验室常用亚硫酸钠(Na
2SO
3)固体与稀硫酸(或稀盐酸)在常温下能发生复分解反应,制取二氧化硫气体.请你共同参与某化学兴趣小组对以下问题的探究:
【查阅资料】①二氧化硫气体是无色有刺激性气味的有毒气体,它的密度比空气大,可溶于水生成亚硫酸(H
2SO
3);②SO
2气体能与KMnO
4溶液反应并能使其颜色变浅或褪色;③CO
2不能与KMnO
4溶液反应.
【探究一】制取二氧化硫
(1)试写出亚硫酸钠(Na
2SO
3)固体与稀硫酸反应的化学方程式:Na
2SO
3+H
2SO
4=Na
2SO
4+H
20+SO
2↑.
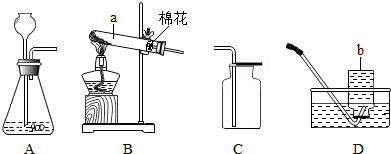
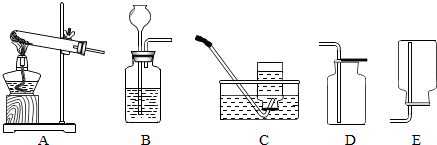
(2)制取并收集二氧化硫时,应选用下图所示的BD装置(填字母);写出实验室用装置A、C 制取
一种常见气体的化学方程式2KMnO
4$\frac{\underline{\;\;△\;\;}}{\;}$K
2MnO
4+MnO
2+O
2↑.
(3)某同学设计出如下图1 所示装置制取并检验SO
2的性质.你认为该装置的优点有减少污染(答一点);滴斗内反应的化学方程式为Ca(OH)
2+SO
2═CaSO
3↓+H
2O.
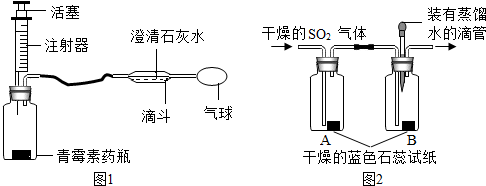
【探究二】二氧化硫与水反应
化学兴趣小组的同学将制得的二氧化硫气体经过干燥后,通过如上图2 装置进行探究:
实验步骤:①将滴管内的蒸馏水滴到B 瓶中的蓝色石蕊试纸上,试纸颜色没有发生变化;
②通入干燥的SO
2气体,发现A 瓶中试纸不变色,B 瓶中试纸变成红色.
(1)该兴趣小组同学设计的以上实验方案运用了控制变量研究的方法.
(2)通过上述实验能得出的结论是H
2O+SO
2═H
2SO
3(用化学方程式表示).
(3)小东同学认为,上图2 装置中有一个明显的不足之处,该装置的缺陷是没有收集实验尾气,容易造成空气污染.
【探究三】确定白色固体M 的成分老师交给兴趣小组一包白色固体M,并告知M 的成分为铝粉、亚硫酸钠、
硫酸钠、碳酸钠中的一种或多种.于是,同学们设计如下装置进行探究:(假设装置中的药品均足量,每次反应均完全)操作步骤:倾斜装置A,使稀硫酸(足量)与固体M 充分反应,待反应停止后,B中溶液紫红色变浅并增重,C 中液体增重.反应结束后,量气管共收集到VmL气体.试回答下列问题:
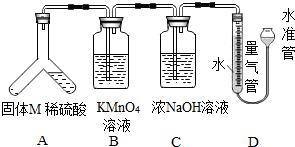
(1)固体M 中一定含有的物质有Al、Na
2SO
3、Na
2CO
3(填化学式).
(2)B、C装置能否交换位置?为什么?否,B装置用来检验并吸收二氧化硫气体,C装置用来吸收二氧化碳气体,若交换位置,将无法判断是否存在二氧化硫气体,即无法判断M中是否含有亚硫酸钠.
(3)只通过上述实验,还有一种物质在固体M 中是否存在不能确定.为进一步确定该物质是否存在,有同学
提出如下方案:实验完毕后,拆下仪器A,向其中加入BaCl
2溶液,观察是否有沉淀生成.你认为此方案
是否可行?理由是不可行,因为Na
2SO
3、Na
2CO
3与H
2SO
4反应生成Na
2SO
4,若不可行,请提出改进方案可将稀硫酸换成稀盐酸(如上面答“可行”,此空不填)

 如图为家庭中常见的电热水壶,请回答下列问题:
如图为家庭中常见的电热水壶,请回答下列问题: