
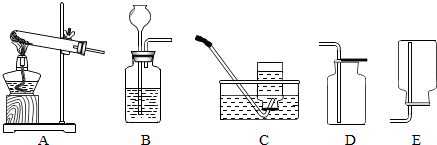
分析 【探究一】(1)制取装置包括加热和不需加热两种,实验室常用亚硫酸钠(Na2SO3)固体与稀硫酸在常温下反应制取二氧化硫气体,且同时生成硫酸钠和水,因此不需要加热;(2)实验室常用亚硫酸钠(Na2SO3)固体与稀硫酸在常温下反应制取二氧化硫气体,且同时生成硫酸钠和水,因此不需要加热;二氧化硫的密度比空气的大,溶于水且与水反应生成亚硫酸(H2SO3),因此只能用向上排空气法收集;实验室用装置A、C可 制取一种常见气体氧气;
(3)根据二氧化硫与氢氧化钙反应生成亚硫酸钠和水,污染空气的实验尾气不能随意排放分析作答.
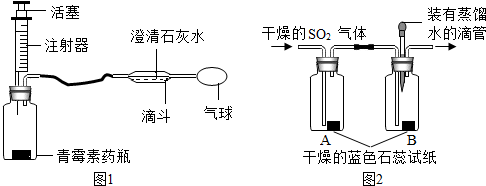
【探究二】实验步骤:根据二氧化碳能够和水反应生成碳酸,二氧化硫的化学性质和二氧化碳相似分析解答;
①将滴管内的蒸馏水滴到B 瓶中的蓝色石蕊试纸上,试纸颜色没有发生变化;
②通入干燥的SO2气体,发现A 瓶中试纸不变色,B 瓶中二氧化硫和水生成了酸使试纸变色,试纸变成红色.
(1)该兴趣小组同学设计的以上实验方案运用了控制变量研究的方法.
(2)通过上述实验能得出的结论是 二氧化硫与水反应生成的酸使试纸变成红色.
(3)上图2 装置中有收集没实验尾气,容易造成空气污染.
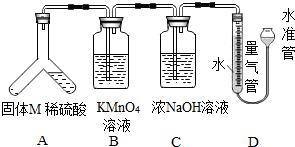
【探究三】:倾斜装置A,使稀硫酸(足量)与固体M 充分反应,待反应停止后,B中溶液紫红色变浅并增重,说明A中有能被高锰酸钾溶液氧化的气体生成,能被酸性高锰酸钾氧化的气体为二氧化硫,所以固体M中含有Na2SO3;C中液体增重,说明A中还有二氧化碳生成,二氧化碳和氢氧化钠溶液反应导致C装置质量增加,所以固体M中还有Na2CO3;反应结束后,量气管共收集到VmL气体,说明经过B、C装置后还有不溶于溶液的气体产生,只能是氢气,所以固体M中还有Al,再结合题目分析解答.
解答 解:【探究一】(1)实验室常用亚硫酸钠(Na2SO3)固体与稀硫酸在常温下反应制取二氧化硫气体,且同时生成硫酸钠和水,故答案为:Na2SO3+H2SO4=Na2SO4+H20+SO2↑;
(2)亚硫酸钠(Na2SO3)固体与稀硫酸在常温下反应,因此不需要加热;二氧化硫的密度比空气的大,溶于水且与水反应生成亚硫酸(H2SO3),因此只能用向上排空气法收集,实验室用装置A、C 在加热条件下使高锰酸钾分解生成锰酸钾、二氧化锰和氧气,反应的化学方程式是2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
故答案为:BD;反应的化学方程式是2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(3)某同学设计出如图1所示装置制取并检验SO2的性质,对污染空气的实验尾气不随意排放.你认为该装置的优点有:减少污染;二氧化硫与氢氧化钙反应生成亚硫酸钠和水,滴斗内反应的化学方程式为:Ca(OH)2+SO2═CaSO3↓+H2O.
【探究二】①将滴管内的蒸馏水滴到B 瓶中的蓝色石蕊试纸上,试纸颜色没有发生变化;
②通入干燥的SO2气体,发现A 瓶中试纸不变色,B 瓶中二氧化硫和水生成了酸使试纸变色,试纸变成红色.
(1)该兴趣小组同学设计的以上实验方案运用了控制变量研究的方法.
(2)通过上述实验能得出的结论是 二氧化硫与水反应生成的酸使试纸变成红色,用化学方程式表示:H2O+SO2═H2SO3.
(3)上图2 装置中没有收集实验尾气,容易造成空气污染,即上图2 装置中有一个明显的不足之处,该装置的缺陷是:没有收集实验尾气,容易造成空气污染.
【探究三】:倾斜装置A,使稀硫酸(足量)与固体M 充分反应,待反应停止后,B中溶液紫红色变浅并增重,说明A中有能被高锰酸钾溶液氧化的气体生成,能被酸性高锰酸钾氧化的气体为二氧化硫,所以固体M中含有Na2SO3;C中液体增重,说明A中还有二氧化碳生成,二氧化碳和氢氧化钠溶液反应导致C装置质量增加,所以固体M中还有Na2CO3;反应结束后,量气管共收集到VmL气体,说明经过B、C装置后还有不溶于溶液的气体产生,只能是氢气,所以固体M中还有Al,再结合题目分析解答.
(1)通过以上分析可知,固体M 中一定含有的物质有:Al、Na2SO3、Na2CO3.
(2)B、C装置不能交换位置,因为B装置用来检验并吸收二氧化硫气体,C装置用来吸收二氧化碳气体,若交换位置,将无法判断是否存在二氧化硫气体,即无法判断M中是否含有亚硫酸钠.
(3)通过以上分析可知,还有一种不能确定存在的物质是Na2SO4.为进一步确定该物质是否存在,有同学提出如下方案:实验完毕后,拆下仪器A,向其中加入BaCl2溶液,观察是否有沉淀生成,此方案不可行,因为Na2SO3、Na2CO3与H2SO4反应生成Na2SO4,会干扰对结果的判断;可将稀硫酸换成稀盐酸,即能防止如上干扰.
故本题答案为::【探究一】(1)Na2SO3+H2SO4=Na2SO4+H20+SO2↑;
(2)BD;2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(3)减少污染;Ca(OH)2+SO2═CaSO3↓+H2O.
【探究二】②红.
(1)控制变量.
(2)H2O+SO2═H2SO3.
(3)没有收集实验尾气,容易造成空气污染.
【探究三】:(1)Al、Na2SO3、Na2CO3.
(2)否,B装置用来检验并吸收二氧化硫气体,C装置用来吸收二氧化碳气体,若交换位置,将无法判断是否存在二氧化硫气体,即无法判断M中是否含有亚硫酸钠.
(3)不可行,因为Na2SO3、Na2CO3与H2SO4反应生成Na2SO4,会干扰对结果的判断;将稀硫酸换成稀盐酸.
点评 此题为二氧化碳的水溶液能使石蕊变红的同类题,完成此题时可从题干叙述中提取有用的信息,依据二氧化碳的有关性质类比设计实验证明二氧化硫的性质,能够考查学生的知识迁移能力.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题
 如图为家庭中常见的电热水壶,请回答下列问题:
如图为家庭中常见的电热水壶,请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用水灭火,是因为水能降低可燃物的着火点 | |
| B. | 铝抗腐蚀性比铁强,是因为铝不及铁活泼 | |
| C. | 使用石墨做铅笔芯,是因为石墨化学性质稳定 | |
| D. | 食品防腐远离甲醛,是因为甲醛能使人体蛋白质变性 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | KMnO4$\stackrel{△}{→}$O2$→_{△}^{Fe}$Fe2O3$\stackrel{H_{2}O}{→}$Fe(OH)3 | |
| B. | CaCO3$\stackrel{高温}{→}$CaO$\stackrel{H_{2}O}{→}$Ca(OH)2溶液$→_{溶液}^{Na_{2}CO_{3}}$NaOH溶液 | |
| C. | CuO$\stackrel{稀H_{2}SO_{4}}{→}$CuSO4溶液$\stackrel{Hg}{→}$HgSO4溶液$\stackrel{△}{→}$HgO$\stackrel{△}{→}$O2 | |
| D. | Cu$\stackrel{稀HCl}{→}$CuCl2$\stackrel{KOH}{→}$Cu(OH)2$\stackrel{△}{→}$CuO |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
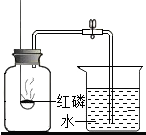 “空气中氧气含量的测定”有多种方法.甲生设计了如图如示的实验方案:在燃烧匙内盛过量红磷,点燃后立即插入集气瓶内,塞紧橡皮塞,待红磷火焰熄灭,集气瓶冷却至室温,打开铁夹,水注入集气瓶.回答下列问题:
“空气中氧气含量的测定”有多种方法.甲生设计了如图如示的实验方案:在燃烧匙内盛过量红磷,点燃后立即插入集气瓶内,塞紧橡皮塞,待红磷火焰熄灭,集气瓶冷却至室温,打开铁夹,水注入集气瓶.回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
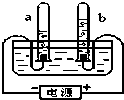 如图是电解水的装置.试回答下列问题:通电后电极上产生气泡,并汇集到试管上端.正极产生的气体是氧气,若负极产生气体的体积为10ml,则正极产生气体的体积为5ml;该实验说明水是由氢元素和氧元素 组成,电解
如图是电解水的装置.试回答下列问题:通电后电极上产生气泡,并汇集到试管上端.正极产生的气体是氧气,若负极产生气体的体积为10ml,则正极产生气体的体积为5ml;该实验说明水是由氢元素和氧元素 组成,电解查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com