
| A. | 放出氧气的总量不变、速率会变快 | B. | 放出氧气的总量会增加、速率变快 | ||
| C. | 放出氧气的总量和速率不受影响 | D. | 放出氧气的总量会减少 |
分析 在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质叫做催化剂(又叫触媒).催化剂的特点可以概括为“一变二不变”,一变是能够改变化学反应速率,二不变是指质量和化学性质在化学反应前后保持不变.
解答 解:催化剂只能改变化学反应速率,但对生成物的质量无影响,使用催化剂不能增加生成物的质量.
A、用双氧水制取氧气时,加了催化剂,放出氧气的总量不变,放出氧气的速率会变快,故选项说法正确.
B、用双氧水制取氧气时,加了催化剂,放出氧气的总量不变,故选项说法错误.
C、用双氧水制取氧气时,加了催化剂,放出氧气的总量不变,放出氧气的速率会变快,故选项说法错误.
D、用双氧水制取氧气时,加了催化剂,放出氧气的总量不变,故选项说法错误.
故选:A.
点评 本题难度不大,考查对催化剂概念的理解,掌握催化剂的特征(“一变二不变”)是正确解答本题的关键


科目:初中化学 来源: 题型:解答题
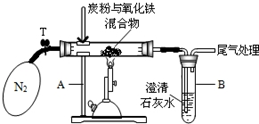 某学生小组对过量碳粉与氧化铁反应产物中气体的成分进行研究.
某学生小组对过量碳粉与氧化铁反应产物中气体的成分进行研究.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
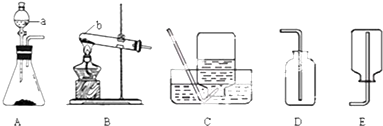
 实验室制取氧气的装置如图所示,下列有关叙述合理的是( )
实验室制取氧气的装置如图所示,下列有关叙述合理的是( )| A. | 锥形瓶里加入少量MnO2粉末,分液漏斗里盛放6%双氧水 | |
| B. | 锥形瓶里加入高锰酸钾固体,分液漏斗里盛放蒸馏水 | |
| C. | 该装置的优点是能控制反应的发生和停止 | |
| D. | 当发生装置中液体与固体一接触产生了气泡即刻收集 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
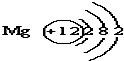 已知镁元素的原子结构示意图如图.请回答:
已知镁元素的原子结构示意图如图.请回答: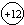 表示的意义核内有12个质子;
表示的意义核内有12个质子;查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验序号 | 氯酸钾质量 | 其它物质质量 | 待测数据 |
| ① | 1.5g | ||
| ② | 1.5g | CuO 0.5g | |
| ③ | 1.5g | MnO2 0.5g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com