
【题目】某工业铁红(Fe2O3)样品中可能混有一种黑色的金属氧化物杂质.根据工业制取铁红分析,该杂质可能是FeO或CuO,兴趣小组同学为探究样品中是否含有杂质及杂质的成分,进行如下实验.
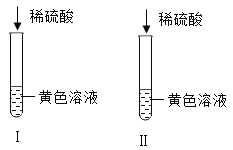
(1)甲组同学分别取质量相等的样品和Fe2O3,加入试管Ⅰ、Ⅱ中,然后加入等体积稀硫酸进行如图对照实验,并得出结论:样品中不含杂质,你认为该结论__(填“合理”或“不合理”.)
(2)乙组同学按下列步骤进行实验:
收集资料
①上述三种氧化物在加热条件下,都能与氢气反应得到相应的金属单质和水.
②三种氧化物中氧元素的质量分数由大到小的顺序为__.
③铁粉中混有少量铜时,难以从金属颜色确定是否含有金属铜.
(3)设计方案进行实验
乙组同学用如图装置进行实验(碱石灰是氧化钙与氢氧化钠固体混合物).
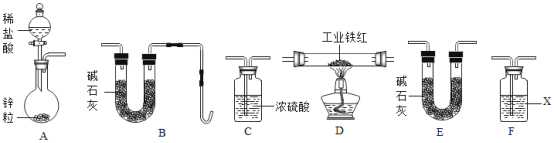
①乙组同学的实验装置中,依次连接的合理顺序为A→F→___→__→__→B,检查装置气密性后,向各装置中加入药品,装置F中试剂X是__溶液,
②下列实验操作步骤的合理顺序是__(填写操作编号).
a 加热装置D中反应管
b 检验H2的纯度
c 打开装置A中分液漏斗活塞,向圆底烧瓶中加入稀盐酸
③该实验处理尾气的方法是_____________________.
实验分析与结论
(4)乙组同学的两次实验数据如表:(两次实验工业铁红均与氢气完全反应)
实验编号 | 加入装置D中工业铁红的质量(g) | 实验后装置E的增重(g) |
1 | 8.0 | 2.6 |
2 | 16.0 | 5.2 |
①分析数据,你的实验结论是_____________.
②请帮助乙组同学设计实验方案确认该样品中杂质的成分______________.
【答案】不合理 氧化铁、氧化亚铁、氧化铜 C D E 氢氧化钠 cba 将氢气点燃或用气球收集 该工业铁红样品中含有FeO或CuO 取少量装置D中的固体于试管中,加入足量稀硫酸,震荡,若固体全部溶解,则含FeO,若固体不完全溶解,则含CuO
【解析】
(1)氧化铁与硫酸反应,生成硫酸铁,铁离子为黄色,固体中一定有氧化铁,和硫酸反应一定生成硫酸铁,溶液一定显黄色,故不合理;故填:不合理;
(2)把三种氧化物Fe2O3、FeO、CuO中氧原子个数变为3,则为Fe2O3、Fe3O3、Cu3O3,相对分子质量的大小为:Cu3O3>Fe3O3>Fe2O3相对分子质量越大,氧元素的质量分数越小,故三种氧化物中氧元素的质量分数由大到小的顺序为:氧化铁、氧化亚铁、氧化铜;故填:氧化铁、氧化亚铁、氧化铜;
(3)设计方案进行实验
①锌与盐酸反应生成氢气和水,盐酸具有挥发性,氢气从A中逸出时,常混有氯化氢和水蒸气,为得到干燥的氢气,氯化氢可以用氢氧化钠溶液吸收,浓硫酸具有吸水性,可以干燥氢气;然后通入D中与工业铁红反应,生成的水被碱石灰吸收,故乙组同学的实验装置中,依次连接的合理顺序为A→F→C→D→E→B;故填:C;D;E;氢氧化钠;
②实验操作步骤的合理顺序是:打开装置A中分液漏斗活塞,向圆底烧瓶中加入稀盐酸,收集一定量的氢气,检验H2的纯度,将纯净的氢气通入装置D中通一会,再加热装置D中反应管;否则易发生爆炸;故填:cba;
③该实验处理尾气的方法是将氢气点燃或用气球收集;故填:将氢气点燃或用气球收集。
实验分析与结论
(4)①假设8g工业铁红全部是氧化铁,氢气与8g氧化铁反应生成水的质量=8g×![]() ÷
÷![]() =2.7g
=2.7g
假设8g工业铁红全部是氧化亚铁,氢气与8g氧化亚铁反应生成水的质量=8g×![]() ÷
÷![]() =2g
=2g
假设8g工业铁红全部是氧化铜,氢气与8g氧化铜反应生成水的质量=8g×![]() ÷
÷![]() =1.8g,
=1.8g,
而表中数据为2.6g,可能含有的两种杂质生成的水都少于2.6g,说明样品中有杂质,若杂质为FeO,则产物为Fe,若杂质为CuO,则产物为Cu.该工业铁红样品中含有杂质或该工业铁红样品中含有FeO或CuO;故填:该工业铁红样品中含有FeO或CuO;
②取少量装置D中的固体于试管中,加入足量稀硫酸,震荡,若固体全部溶解,则含FeO,若固体不完全溶解,则含CuO。
故填:取少量装置D中的固体于试管中,加入足量稀硫酸,震荡,若固体全部溶解,则含FeO,若固体不完全溶解,则含CuO,因为铜与稀硫酸不反应。


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
【题目】比较与分析归纳会使你的头脑变得更职明。请分析下表中信息,回答有关问题:
名称 | 符号 | 原子结构示意图 | 单质化学式 | 常温常压下状态 | 单质与氢气反应 |
氟 | F |
| F2 | _________ | 黑暗处爆炸 |
氯 | Cl |
| Cl2 | 气态 | 光照爆炸 |
溴 | Br |
| Br2 | 液态 | 加热反应 |
碘 | I |
| _________ | 固态 | 持续加热缓慢反应 |
(1)请写出上述表中的空格处应补充的内容
(2)试归纳氟、氯、溴、碘对应单质的性质变化规律(答一点即可):_________。已知:Cl2和Br2的化学性质相似,![]() ,其中/span>HClO也是一种酸,试写出Br2与水反应的化学方程式__________。
,其中/span>HClO也是一种酸,试写出Br2与水反应的化学方程式__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(7分)某食盐样品中含有少量沙土、氯化钙和氯化镁。以下是除去食盐样品中沙土、氯化钙和氯化镁的实验流程:
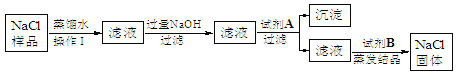
根据流程图回答:
(1)操作Ⅰ的名称是 ,加入的试剂A是 ,沉淀是 ;
(2)写出NaOH与杂质反应的化学方程式 ;(2分)
(3)加入试剂B的目的是 ;
(4)蒸发结晶时用到玻璃棒的作用是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法正确的是( )
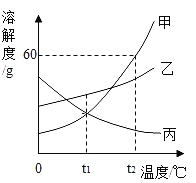
A.t1℃时,三种固体物质的溶解度关系为乙>甲>丙
B.t2℃100 g甲物质饱和溶液中含有60 g甲
C.将丙物质饱和溶液变为不饱和溶液,可采用升温的方法
D.t2℃时分别用100 g水配制甲、乙的饱和溶液,降温到t1℃,析出固体的质量甲>乙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请回忆你学习过的“质量守恒定律”的实验探究,并按要求完成实验方案一和实验方案二。(下表中“实验结论”填“=”“>”或“<”)
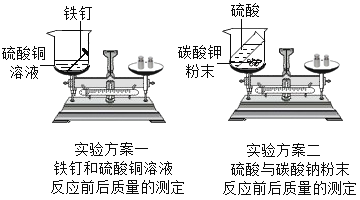
实验方案 | 方案一 | 方案二 |
反应现象 | 铁钉表面覆盖一层红色的物质,溶液由蓝色变成__________色 | 有气泡产生 |
化学方程式 | ________________ | H2SO4+K2CO3= K2SO4+CO2 |
反应前的总质量 | m1 | n1 |
反应后的总质量 | m2 | n2 |
实验结论 | m1_______m2 | n1________n2 |
将两个实验结果进行讨论对比时,有同学有一个方案观察到天平不平衡,是因为________,因此不能说质量不守恒。在反应物不变的前提下,要使天平平衡,你对该方案的改进措施是___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水是最重要的自然资源,也是生命之源。
(1) 为了人类和社会经济的可持续发展,我们必须爱护水资源,节约用水是每个公民的责任和义务。下列做法属于节约用水的是_____ (选填序号)。
A 城市生活废水直接排入河流 B 农业上合理使用化肥和农药
C 工业上冷却水循环使用 D 用水后及时关闭水龙头
(2)饮用酸碱度过大或硬度过大的水都不利于人体健康。在生活中可用_________区分硬水和软水。
(3)下面是某化学反应前后的微观模拟图(反应条件省略),请根据图示回答:
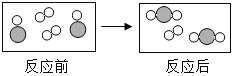
该化学反应中,参加反应的“![]() ”和“
”和“![]() ”与反应后生成
”与反应后生成![]() 的各粒子间的个数比为______;
的各粒子间的个数比为______;
(4)下图是两种元素在周期表中的信息。请回答:
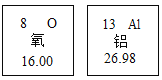
若铝离子的结构示意图为: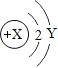 ,则Y=______。
,则Y=______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是实验室制取气体的一些装置,据图回答有关问题。
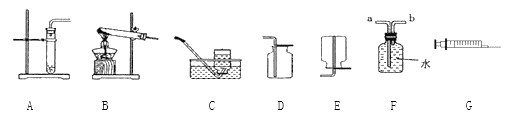
(1)同学们已经在实验室体验过用高锰酸钾制氧气的过程,请写出该反应的表达式_____;该反应的发生装置可选用上图的_____,该装置中试管口略向下倾斜的原因是________;但有同学提出该装置有一处不完善的地方,请你指出_______。
(2)氧气的收集装置可选用C;也可选用装置________,选择该装置的原因是__________,验满的方法为_________。有同学认为可用装置F收集一瓶氧气,请问氧气应从______(填“a”或“b”)端进入。
(3)如果有同学想用过氧化氢溶液和二氧化锰混合制取氧气,请问该同学可以选用上述发生装置的_______,该反应的表达式为___________。由于该反应比较难操控,所以没让同学们用这组药品在实验室制取氧气,但聪明的小美认为只要把上图中的_____和______组合作为发生装置就可以获得平稳的气流。
(4)实验室在常温下用颗粒状大理石与稀盐酸(液体)反应制取可溶于水、密度比空气大的二氧化碳气体,请问制取二氧化碳气体的发生装置选用上图的_____,收集装置选用上图的_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】蛋白质是由丙氨酸(C3H7NO2)等多种氨基酸构成的。根据丙氨酸的化学式计算:
(1)C3H7NO2的相对分子质量是______。
(2)丙氨酸中各元素的质量比C:H:N:O=______。
(3)丙氨酸中氮元素的质量分数为______(结果保留0.1%)
(4)8.9g C3H7NO2中含有氢元素的质量是______g。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小红进行酸碱中和反应的实验(如图所示).她向氢氧化钠溶液中滴加一定量稀盐酸后,想起氢氧化钠溶液中事先没有滴加指示剂,为了确定盐酸与氢氧化钠的反应程度,她从烧杯中取了少量溶液于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到试管中溶液颜色没有变化.于是她对烧杯中的溶液进行了以下探究:
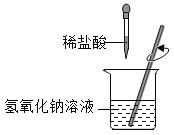
(1)小红认为此时烧杯中的溶液可能有以下三种情况:
①盐酸与氢氧化钠恰好完全反应;②氢氧化钠有剩余;③盐酸过量.
小明同学却断定不可能“氢氧化钠有剩余”,他的理由是:_____;
(2)他们共同设计了一个实验方案,欲对上述其他两种可能情况进行验证.请根据相关内容填写如表:
试验方法 | 可能观察到的现象 | 结论 |
将少量锌粒放入试管中,然后从烧杯中取适量溶液至试管中. | 如果______ | 则盐酸过量 |
如果______ | 盐酸与氢氧化钠恰好完全反应 |
(3)经过讨论,他们认为利用下列几种物质代替锌粒,也可以达到验证目的.你认为其中不正确的是____(填序号).
A生锈的铁钉 B碳酸钠粉末 C硫酸钠粉末 D氢氧化铜
(4)若采用pH试纸证明该反应恰好中和,具体方法为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com