
| A. | 用燃着的木条区分空气和二氧化碳 | |
| B. | 用氢氧化钠溶液除去二氧化碳气体中混有的HCl | |
| C. | 用水区分CuSO4和KNO3 粉末 | |
| D. | 用酚酞试液区分稀盐酸和食盐水 |
分析 根据两种物质与同种试剂反应产生的不同现象来鉴别它们,若两种物质与同种物质反应的现象相同,则无法鉴别它们.
解答 解:A、二氧化碳不能燃烧、不能支持燃烧,能使燃着的木条熄灭,空气不能,可以鉴别,故选项错误.
B、CO2和HCl气体均能与NaOH溶液反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,方法不合理,故选项正确.
C、CuSO4和KNO3 粉末均易溶于水,分别形成蓝色溶液、无色溶液,可以鉴别,故选项错误.
D、稀盐酸和食盐水分别显酸性、中性,使酚酞溶液均显示无色,不能鉴别,方法不合理,故选项正确.
故选:BD.
点评 本题有一定难度,在解决鉴别物质题时,判断的依据是:所选试剂需要与待鉴别的物质反应并出现明显不同的现象.


科目:初中化学 来源: 题型:选择题
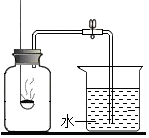 如图装置可用于测定空气中氧气的含量,实验前在集气瓶中加入少量的水,并做上记号.有关该实验的下列说法中,不正确的是( )
如图装置可用于测定空气中氧气的含量,实验前在集气瓶中加入少量的水,并做上记号.有关该实验的下列说法中,不正确的是( )| A. | 实验时红磷一定要过量 | |
| B. | 实验时先要检验装置的气密性 | |
| C. | 没有使装置冷却到室温就打开弹簧夹会使测得的数值偏小 | |
| D. | 可以把实验中使用的红磷换为足量的木炭 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. |  向一定量稀硫酸中加入NaOH溶液 | B. | 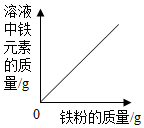 向一定量稀盐酸中加入铁粉 | ||
| C. | 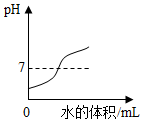 向硝酸溶液中逐滴加入水 | D. | 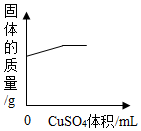 向一定量铁粉中加入CuSO4溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | K2SO4、Na2CO3、NaCl | B. | NaHCO3、K2SO4、HNO3 | ||
| C. | Fe(NO3)3、HCl、CuSO4 | D. | MgCl2、Na2SO4、NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
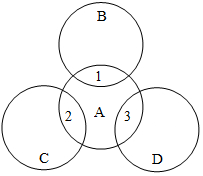 A、B、C、D分别是铁、盐酸、碳酸钠溶液、氢氧化钠溶液中的一种,其反应关系如图所示,图中两圆相交部分1、2、3表示两种物质间反应的主要现象,其中1无明显现象.请思考下列问题:
A、B、C、D分别是铁、盐酸、碳酸钠溶液、氢氧化钠溶液中的一种,其反应关系如图所示,图中两圆相交部分1、2、3表示两种物质间反应的主要现象,其中1无明显现象.请思考下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 超临界水可处理有机毒物 | B. | 超临界水是一种新物质 | ||
| C. | 超临界水是水的一种状态 | D. | 超临界水氧化技术不形成二次污染 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
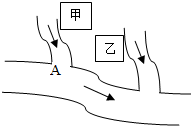 如图所示,甲、乙两个相邻的工厂向河水中排放的废水中分别含有CuSO4、NaOH、BaCl2、FeCl3四种物质中的两种.某中学环保小组对河水取样测试时发现A处河水的pH>7.试回答:
如图所示,甲、乙两个相邻的工厂向河水中排放的废水中分别含有CuSO4、NaOH、BaCl2、FeCl3四种物质中的两种.某中学环保小组对河水取样测试时发现A处河水的pH>7.试回答:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 所取合金的质量∕g | 10 | 10 | 20 | 30 |
| 所加稀硫酸的质量∕g | 100 | 120 | 80 | X |
| 生成氢气的质量∕g | 0.3 | 0.3 | 0.3 | Y |

| 实验序号 | 铁的氧化物质量/g | 生成铁的质量/g |
| 1 | 4.00 | 2.81 |
| 2 | 8.00 | 7.62 |
| 3 | 10.00 | 7.01 |
| 4 | 12.00 | 8.42 |
| 5 | 14.00 | 9.81 |
| 6 | 16.00 | 11.22 |
| 7 | 18.00 | 12.63 |
| 8 | 20.00 | 14.03 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com