
【题目】在某密闭容器中,加入一定质量的甲、乙、丙、丁四种物质,一段时间后,测得各物质 的质量如下表。下列说法正确的是( )
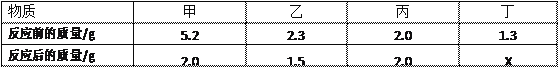
A. 丙一定是催化剂 B. X 的值是 5.3
C. 参加反应的甲、乙质量比为 4:3 D. 丁可能是单质
【答案】B
【解析】由表中数据分析可知,反应前后甲的质量减少了5.2g-2.0g=3.2g,故是反应物,参加反应的甲的质量为5.2g-2.0g=3.2g;同理可以确定乙是反应物,参加反应的乙的质量为2.3g-1.5g=0.8g;丙的质量不变,可能作该反应的催化剂,也可能没有参加反应。由质量守恒定律,丁应是生成物,生成的丁的质量为3.2g+0.8g=4g,故X的数值为1.3g+4g=5.3g。A、丙的质量不变,可能作该反应的催化剂,也可能没有参加反应,错误;B、X的数值为1.3g+4g=5.3g,正确;C、参加反应的甲、乙质量比为3.2g:0.8g=4:1,错误;D、该反应的反应物为甲和乙,生成物是丁,符合“多变一”的特征,属于化合反应,丁是化合反应的生成物是化合物,不可能是单质,错误。故选B。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:初中化学 来源: 题型:
【题目】以下是实验室制取和收集气体的装置图:
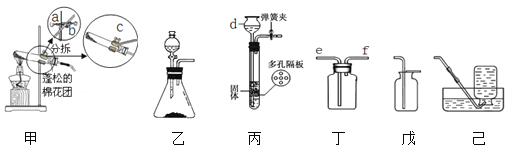
(1)仪器d的名称是________。
(2)加热KMnO4制取O2,写出反应的化学方程式:_____________;当用铁夹固定好试管后,要使试管口略低于试管底部,应调节螺旋____(选填“a” “b”或“c”)。
(3)实验室用锌和稀硫酸制取氢气,写出反应的化学方程式:_____________;为使反应随开随制随关随停,应选用的发生装置是___(选填装置编号)。收集氢气应选择的装置是_____(选填 “戊”或“己”),若用装置丁作收集装置,收集时气体应从导管的____(填“e”或“ f ”)端通入。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是a、b、c三种固体物质的溶解度曲线,下列说法正确的是( )
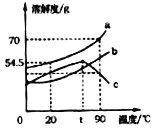
A. a属于易溶性物质
B. t℃时c物质的饱和溶液,可采用升高温度方法使其变为不饱和溶液
C. 90℃时,将50g a物质加入到50g水中充分搅拌,可得到100g a的饱和溶液
D. 将20℃时三种物质的饱和溶液升温到90℃,所得溶液中溶质的质量分数的大小关系是:a>c>b
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硝酸(HNO3)是实验室常见的一种酸。实验小组对硝酸的某些性质进行研究。
Ⅰ.挥发性
(实验1)取一瓶质量分数为68%的浓硝酸,打开瓶盖,遇潮湿的空气,瓶口可以看到________,是由于挥发出来的硝酸蒸体遇到空气里的水蒸气形成硝酸小液滴的缘故。
Ⅱ.不稳定性
(查阅资料1)硝酸是无色液体,见光或受热分解生成红棕色的NO2气体。
(1)硝酸分解的化学方程式为:4HNO3 ![]() 4NO↑+O↑+_____。
4NO↑+O↑+_____。
(实验2)取3份浓度和体积均相同的浓硝酸分别放入3支试管中,塞好塞子,放置在室外阳光充足的地方(气温为26℃)。记录溶液上方的气体颜色随时间的变化情况。
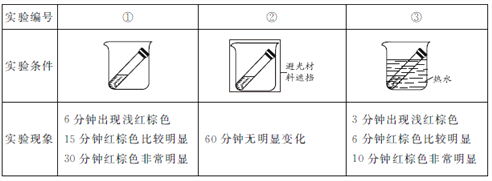
(2)实验①、②对比是研究______对浓硝酸稳定性的影响。
(3)实验①、③对比可得出的结论是_______。
Ⅲ.酸性
(查阅资料2)硝酸能够与金属氧化物反应生成盐和水。
(实验3)向氧化铜粉末中加入硝酸,能够看到的现象是_______。
IV .氧化性
(查阅资料3) 浓硝酸在加热条件下能与木炭发生反应:C+4HNO(浓) ![]() 4NO↑+CO↑+2H2O。
4NO↑+CO↑+2H2O。
(实验4)如图所示,将红热的木炭伸到浓硝酸上方,观察到有红棕色气体产生。请解释生成该红棕色气体的原因可能有________。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化工厂排出的废水溶质可能由硫酸钠、碳酸钠、氯化钠、氢氧化钠中的一种或多种组成,为确认其组成,某化学实验小组进行了如下两组实验。
实验一 | 实验二 | ||||
步骤 | 试剂 | 现象 | 步骤 | 试剂 | 现象 |
① | 取少量废水于烧杯 | / | ① | 取少量废水于烧杯 | / |
② | 滴入少量酚酞 | —— | ② | 滴入过量 | 产生沉淀 |
③ | 继续滴加过量稀盐酸 | 产生气体 | ③ | 过滤得滤液和滤渣 | / |
④ | 继续滴加少量 | 产生沉淀 | ④ | 向滤液中滴入少量酚酞 | 无明显现象 |
⑤ | 过滤取滤液 | / | ⑤ | 继续滴少量 | 产生沉淀 |
⑥ | 向滤液中滴少量 | 无沉淀 | ⑥ | 向滤渣中滴过量稀盐酸 | 沉淀消失 |
根据上述两组实验及其现象,回答下列问题:
(1)实验一步骤②所对应的现象为_____________________________________。
(2)实验一步骤③产生气体的反应的化学方程式为________________________
(3)废水中一定无_________(填化学式,下同),可能有_________________
(4)媛媛为进一步确认废水组成,另取废水进行定量实验,测得其中阳离子与阴离子的个数比约为4:3,由此可知原废水溶质为______________。
(5)实验二为相同实验目的,酚酞可用下列试剂_____(填序号)中任意一种替换。
A.铁粉 B.硝酸铜溶液 C.紫色石蕊 D.稀硝酸
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图示中 A 为生活中使用最多的金属,C 为胃酸的主要成分,G 为蓝色沉淀。各 物质间的反应均在溶液中进行,相互转化关系如下图所示。
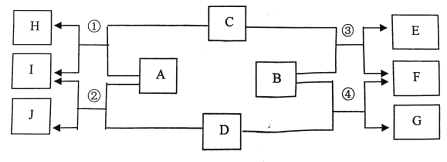
请回答以下问题:
(1)B 溶液中的阴离子是_____,E 的化学式为_____
(2)反应②的化学方程式________
(3)①②③④四个反应中属于复分解反应的是_____
(4)H 的一种用途_____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】人类的生存与发展离不开化学.
(1)2017年5月,我国首架大型客机C919首飞,飞机材料中使用了大量的铝镁合金,铝制品具有“自我保护”能力,原因是____________________________。
(2)2017年5月,我国在南海进行了可燃冰的试开采并获得成功,天然气的主要成分为________ (填化学式),其完全燃烧的化学方程式为______________________。
(3)活性炭净化水,是利用了它的______性,生活中硬水软化的常用方法是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】过氧化钙( CaO2)是用途广泛的优良供氧剂。以电石渣[主要成分为Ca(OH)2,含少量CaCO3]为原料制备CaO2的一种工艺流程如下:
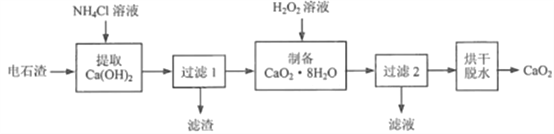
(查阅资料)I. Ca(OH)2+2NH4Cl=CaCl2+2NH3·H2O
Ⅱ.CaCl2+2NH3·H2O+H2O2 +6H2O= CaO2·8H2O↓+ 2NH4Cl
Ⅲ. CaO2·8H2O在水中不太稳定,会缓慢分解。
(1)“提取Ca(OH)2”时反应的基本类型是_______;Ca(OH)2的俗名为_______;“过滤1”所得滤渣的主要成分是_______。
(2)在实验室进行过滤操作时,要遵循“一贴、二低、三靠”原则。其中“二低”指的是:滤纸边缘略低于漏斗口、_______。生产过程中为了精确测定溶液的pH,常使用_______ (填仪器名称)。
(3)在其他条件不变的情况下,制备CaO2·8H2O的反应时间(t)对其产率(w)的影响如图所示。
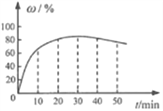
①平均反应速率最快的时间段为:_______ (填字母)。
a. 0~10min b. 10~20min c. 20~30min d.30~40min
②30min后,w开始下降的主要原因是_______。
(4)为了测定加入的NH4Cl溶液中溶质的质量分数,取30.00g NH4Cl溶液于烧杯中,加入稍过量的AgNO3溶液,完全反应后过滤、洗涤、干燥、称量,得到14.35g 白色固体。通过计算确定该溶液中NH4Cl的质量分数(精确到0.1%)____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在一次化学课上,老师提供了以下装置制取二氧化碳并验证其性质。请回答。
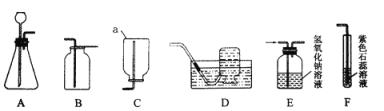
(1)仪器a的名称是_________________。
(2)实验室制取二氧化碳的反应原理是__________________________________(用化学方程式表示)。实验室常用A装置作为制取二氧化碳的发生装置,选择气体发生装置时,应考虑的因素有_______________________;收集二氧化碳应选择的装置是______(填字母序号)。
(3)收集到的二氧化碳中常混有氯化氢气体。要除去二氧化碳中混有的氯化氢,将气体通过E装置能否达到实验目的?____________(填“能”或“否”)。
(4)用F装置验证二氧化碳的性质,通入二氧化碳后,试管中产生的现象是_______ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com