
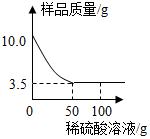
 某化学兴趣小组对某铜锌合金样品进行探究实验.称取样品10.0克,再用100.0克稀硫酸溶液逐滴滴入,实验情况如图所示.求:
某化学兴趣小组对某铜锌合金样品进行探究实验.称取样品10.0克,再用100.0克稀硫酸溶液逐滴滴入,实验情况如图所示.求:分析 铜锌中只有锌和硫酸能反应,所以不断加入硫酸剩余的固体是铜,从图中可以看出固体铜应该是有3.5g.然后根据锌的质量求算氢气.
解答 解:
由于铜锌合金中加入硫酸至过量,剩余的固体就是铜,所以固体铜的质量为3.5g,则锌的质量为10g-3.5g=6.5g则样品中锌的质量分数为$\frac{6.5g}{10g}$×100%=65%.)设反应掉6.5g的锌生成的氢气的质量为x,
Zn+H2SO4═ZnSO4+H2↑
65 2
6.5g x
$\frac{65}{2}$=$\frac{6.5g}{x}$
解得:x=0.2g
答:(1)铜锌合金中,Zn的质量分数是65%;
(2)生成氢气的质量是0.2g.
点评 多种金属遇到一种酸就要考虑是否反应,如果都反应就要考虑反应的前后顺序.


科目:初中化学 来源: 题型:选择题
| A. | CuSO4(Na2SO4) | B. | C (CuO) | C. | KNO3[(NH4)2SO4] | D. | NaCl (MgCl2) |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
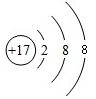
| A. | 该粒子是阴离子 | B. | 该粒子不稳定,容易失去一个电子 | ||
| C. | 该粒子的核电荷数为18 | D. | 该粒子可表示为X+ |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
 工业上可用煅烧黄铁矿(主要成分FeS2)产生的二氧化硫通过下列工艺过程制取氢气.下列说法不正确的是( )
工业上可用煅烧黄铁矿(主要成分FeS2)产生的二氧化硫通过下列工艺过程制取氢气.下列说法不正确的是( )| A. | 采用该流程可以有效缓解温室效应 | |
| B. | 分离器中分离出的副产品是硫酸 | |
| C. | 膜反应器中发生了置换反应 | |
| D. | 生产流程中能被循环利用的物质X为I2 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | $\stackrel{+2}{Mg}$ | B. | $\stackrel{+}{Mg}$ | C. | $\stackrel{2+}{Mg}$ | D. | Mg2+ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 如右图,打开止水夹,将液体A滴入试管②中与固体B反应,两者的反应属于基本反应类型.若试管①中的导管口有较多气泡产生,请写出两组符合上述现象的化学方程式.
如右图,打开止水夹,将液体A滴入试管②中与固体B反应,两者的反应属于基本反应类型.若试管①中的导管口有较多气泡产生,请写出两组符合上述现象的化学方程式.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com