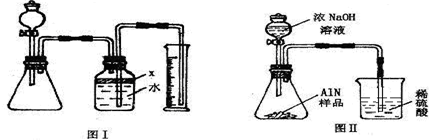
氮化铝(AlN)是一种新型无机材料,广泛应用与集成电路生产领域.某氮化铝中含有碳或氧化铝杂质,现用图Ⅰ中的一些装置来进行检验,使氮化铝样品和NaOH溶液反应AlN+NaOH+H
2O=NaAlO
2+NH
3↑,根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)
(1)实验有关操作为:a、往锥形瓶中放入适量的AlN样品:b、从分液漏斗往锥形瓶中加入过量的浓NaOH;c、检验装置的气密性;d、测定收集到水的体积.正确的操作顺序为
.
(2)本试验中检查装置气密性的方法是
.
(3)广口瓶中的试剂X可选用
(填选项的标号).A 汽油 B 酒精 C 植物油 D CCl
4(4)广口瓶的液体没有装满(上方留有少量空间),实验测得NH
3的体积将
(填偏大、偏小或不变).
(5)实验结束后,若观察到锥形瓶中还有固体,则样品中含有的杂质是
.
(6)若实验中测得样品的质量为wg,氨气的体积为aL(标况下),则样品中AlN的质量分数为
(AlN的相对分子质量为41,每22.4L氨气质量为17g).
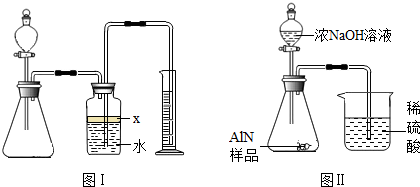
(7)有人改用图Ⅱ装置进行同样实验,通过测定烧杯中硫酸的增重来确定样品中AlN的质量分数.你认为是否可行?
(填入“可行”、“不可行”).原因是
,改进的方法为
.
(8)在mg 20%的氢氧化钠溶液中滴加2~3滴酚酞试液,然后边搅拌边逐滴向其中加入硫酸镁溶液,至溶液的红色完全褪去时,滤去沉淀,称得剩余溶液总质量为3mg.
①计算所加硫酸镁溶液的质量分数;
②用N表示溶液中离子的数目,不同种离子用离子符号注明[如N (Na')表示钠离子的数目],请建立坐标系,绘制上述滴加过程中各种离子的数目随溶液的不断加入而变化的关系图.

 阅读快车系列答案
阅读快车系列答案