
ЎҫМвДҝЎҝИЛАаөДЙъІъЙъ»оАлІ»ҝӘҪрКфЈ®
(1)ҪрКфоС(Ti)өДәПҪрҫЯУРГЬ¶ИРЎЈ¬ИЫөгёЯЎўҝЙЛЬРФәГЈ¬ҝ№ёҜКҙРФЗҝөИРФДЬЈ¬оСәПҪрУлИЛМеУРәЬәГөДЎ°ПаИЭРФЎұЎЈ№ӨТөЙПТұБ¶ҪрКфоСөД№эіМКЗТФоСҝуКҜ(ЦчТӘіЙ·ЦОӘоСЛбСЗМъЈ¬»ҜС§КҪОӘFeTiO3)ЎўҪ№МҝЎўВИЖшОӘФӯБПЈ¬ФЪёЯОВМхјюПВЦЖИЎTiCl4Ј¬Жд·ҙУҰөД»ҜС§·ҪіМКҪОӘЈә2FeTiO3+6C+7Cl2![]() 2TiCl4+2X+6COЈ®И»әуУГГҫУлTiCl4Ј¬ФЪёЯОВМхјюПВ·ҙУҰЙъіЙҪрКфоСәНВИ»ҜГҫЎЈЗлёщҫЭТФЙПРЕПў»ШҙрПВБРОКМвЈә
2TiCl4+2X+6COЈ®И»әуУГГҫУлTiCl4Ј¬ФЪёЯОВМхјюПВ·ҙУҰЙъіЙҪрКфоСәНВИ»ҜГҫЎЈЗлёщҫЭТФЙПРЕПў»ШҙрПВБРОКМвЈә
ўЩFeTiO3ЦРоСФӘЛШөД»ҜәПјЫОӘ_____________ЎЈ
ўЪЦЖИЎTiCl4өД·ҙУҰЦРЈ¬XөД»ҜС§КҪОӘ________________ЎЈ
ўЫГҫУлTiCl4·ҙУҰөД»щұҫАаРНОӘ________________ЎЈ
ўЬПВБР№ШУЪоСәПҪрУГНҫөДЛө·ЁІ»ХэИ·өДКЗ________________ЎЈ
AЈ®ЧцұЈПХЛҝ BЈ®УГУЪәҪҝХЎўәҪМм№ӨТө
CЈ®ЦЖИЛФм№З DЈ®УГУЪҙ¬І°ЎўәЛЗұН§өДЦЖФм
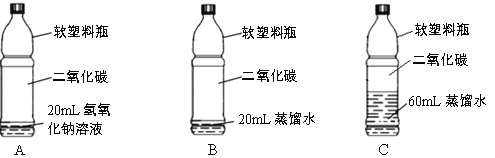
(2)ДіРЎЧйУГНј1ЛщКҫЧ°ЦГ¶ФМъЙъРвөДМхјюҪшРРМҪҫҝЈ®Т»¶ОКұјдәу·ўПЦAЦРМъ¶ӨұнГжЙъРвЈ¬BЦРМъ¶ӨТАИ»№вББЈ¬¶ФұИAЎўBПЦПуЛөГчЈәҫц¶ЁМъЙъРвҝмВэөДТ»ёцЦШТӘТтЛШКЗ______________ЎЈ

(3)Ҫ«ВҜёККҜ(ZnCO3)ЎўіаНӯ(Cu2O)әНДҫМҝ·Ы»мәПәујУИИөҪФј800ЎжЈ¬өГөҪТ»ЦЦРҝәННӯөДәПҪр©Ғ©Ғ»ЖНӯЈ¬Нв№ЫЛЖ»ЖҪрө«ЦКөШјбУІЈ®(МбКҫЈәZnCO3КЬИИ»б·ЦҪвЈ¬ЙъіЙБҪЦЦСх»ҜОпЎЈ)
ўЩРҙіціаНӯәНДҫМҝ·Ы·ҙУҰөД»ҜС§·ҪіМКҪ____________________________________ЎЈ
ўЪУРІ»·ЁЙМИЛУГ»ЖНӯГ°ід»ЖҪрЈ¬ЦЖјЩПъКЫЈ¬ПВБРјшұрХжјЩ»ЖҪрөД·Ҫ·ЁІ»ХэИ·өДКЗ________ЎЈ
AЈ®ЧЖЙХ BЈ®ҝҙНв№Ы CЈ®өОјУПЎСОЛб DЈ®өОјУБтЛбВБИЬТәЈ®
Ўҫҙр°ёЎҝ +4 FeCl3 ЦГ»»·ҙУҰ A СхЖшөДЕЁ¶И C+2Cu2O![]() 4Cu+CO2Ўь BD
4Cu+CO2Ўь BD
ЎҫҪвОцЎҝЈЁ1Ј©ўЩFeTiO3ЦРМъФӘЛШөД»ҜәПјЫОӘ+2јЫЈ¬СхФӘЛШөД»ҜәПјЫОӘ-2јЫЈ¬ЙиоСФӘЛШөД»ҜәПјЫОӘxЈ¬ёщҫЭ»ҜәПОпЦРёчФӘЛШөД»ҜәПјЫөДҙъКэәНОӘ0өГЈ¬2+x+ЈЁ-2Ј©![]() =0Ј¬x=+4Ј¬№КFeTiO3ЦРоСФӘЛШөД»ҜәПјЫОӘ+4јЫЈ»
=0Ј¬x=+4Ј¬№КFeTiO3ЦРоСФӘЛШөД»ҜәПјЫОӘ+4јЫЈ»
ўЪёщҫЭЦКБҝКШәг¶ЁВЙЈ¬·ҙУҰЗ°әуФӯЧУКШәгЈ¬·ҙУҰЗ°УР2ёцМъФӯЧУЈ¬2ёцоСФӯЧУЈ¬6ёцСхФӯЧУЈ¬6ёцМјФӯЧУЈ¬14ёцВИФӯЧУЈ¬·ҙУҰәуТСҫӯУР2ёцоСФӯЧУЈ¬8ёцВИФӯЧУЈ¬6ёцМјФӯЧУЈ¬6ёцСхФӯЧУЈ¬№К2XЦРә¬УР2ёцМъФӯЧУЈ¬6ёцВИФӯЧУЈ¬№К1XЦРә¬УР1ёцМъФӯЧУЈ¬3ёцВИФӯЧУЈ¬»ҜС§КҪОӘFeCl3 Ј»
ўЫГҫУлTiCl4Ј¬ФЪёЯОВМхјюПВ·ҙУҰЙъіЙҪрКфоСәНВИ»ҜГҫЈ¬ёГ·ҙУҰКЗУЙТ»ЦЦөҘЦКәНТ»ЦЦ»ҜәПОп·ҙУҰЙъіЙБнТ»ЦЦөҘЦКәНБнТ»ЦЦ»ҜәПОпЈ¬№ККЗЦГ»»·ҙУҰЈ»
ўЬAЎўҪрКфоС(Ti)өДәПҪрҫЯУРГЬ¶ИРЎЈ¬ИЫөгёЯөДРФЦКЈ¬І»ДЬУГУЪЧцұЈПХЛҝЈ¬ҙнОуЈ»
BЎўҪрКфоС(Ti)өДәПҪрҫЯУРГЬ¶ИРЎЈ¬ИЫөгёЯЎўҝЙЛЬРФәГЈ¬ҝ№ёҜКҙРФЗҝөИРФДЬЈ¬ҝЙУГУЪУГУЪәҪҝХЎўәҪМм№ӨТөЈ¬ХэИ·Ј»CЎўҪрКфоСУлИЛМеУРБјәГөДПаИЭРФЈ¬ҝЙТФЧцИЛФм№ЗчАЈ¬ХэИ·Ј»DЎўУЙоСөДРФЦКҫц¶ЁЈ¬оСҝЙУГУЪҙ¬І°ЎўәЛЗұН§өДЦЖФмЈ¬ХэИ·Ј»№КСЎAЎЈ
ЈЁ2Ј©BЧ°ЦГЦРУлAЧ°ЦГЦРПаұИЈ¬СхЖшөДЕЁ¶ИҪПөНЈ¬·ҙУҰЛЩВКҪПВэЈ¬ЛөГчҫц¶ЁМъЙъРвҝмВэөДТ»ёцЦШТӘТтЛШКЗСхЖшөДЕЁ¶ИЈ»
ЈЁ3Ј©ўЩСх»ҜСЗНӯУлДҫМҝ·ҙУҰЙъіЙНӯәН¶юСх»ҜМјЈ¬·ҙУҰ·ҪіМКҪОӘЈәC+2Cu2O![]() 4Cu+CO2ЎьЈ»ўЪAЎўНӯәНРҝјУИИәуУлҝХЖшЦРөДСхЖш·ҙУҰЈ¬ұнГж»бұдОӘәЪЙ«Ј¬¶ш»ЖҪрІ»УлСхЖш·ҙУҰЈ¬СХЙ«І»·ўЙъұд»ҜЈ¬№КХэИ·Ј»BЎў»ЖНӯәН»ЖҪрөДНв№Ы·ЗіЈПаЛЖЈ¬№КІ»ДЬНЁ№э№ЫІмСХЙ«ЗшұрЈ¬ҙнОуЈ»CЎў»ЖНӯЦРөДРҝҝЙТФУлПЎСОЛб·ҙУҰГ°іцЖшЕЭЈ¬¶ш»ЖҪрІ»ДЬЈ¬ХэИ·Ј»DЎўНӯЎўРҝЎўҪр¶јГ»УРВБ»оЖГЈ¬¶јІ»ДЬҪ«ВБЦГ»»іцАҙЈ¬№КҙнОуЈ»№КСЎBDЎЈ
4Cu+CO2ЎьЈ»ўЪAЎўНӯәНРҝјУИИәуУлҝХЖшЦРөДСхЖш·ҙУҰЈ¬ұнГж»бұдОӘәЪЙ«Ј¬¶ш»ЖҪрІ»УлСхЖш·ҙУҰЈ¬СХЙ«І»·ўЙъұд»ҜЈ¬№КХэИ·Ј»BЎў»ЖНӯәН»ЖҪрөДНв№Ы·ЗіЈПаЛЖЈ¬№КІ»ДЬНЁ№э№ЫІмСХЙ«ЗшұрЈ¬ҙнОуЈ»CЎў»ЖНӯЦРөДРҝҝЙТФУлПЎСОЛб·ҙУҰГ°іцЖшЕЭЈ¬¶ш»ЖҪрІ»ДЬЈ¬ХэИ·Ј»DЎўНӯЎўРҝЎўҪр¶јГ»УРВБ»оЖГЈ¬¶јІ»ДЬҪ«ВБЦГ»»іцАҙЈ¬№КҙнОуЈ»№КСЎBDЎЈ



| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәіхЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДіСРҫҝРЎЧйУГПВНјЛщКҫЧ°ЦГЈ¬МҪҫҝДЬ·сУГГҫМхҙъМжәмБЧІв¶ЁҝХЖшЦРСхЖшә¬БҝЎЈ
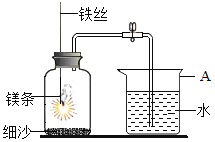
КөСйЗ°Ј¬РЎЧйіЙФұМбіцБЛІ»Н¬өДІВПлЎЈ
ЎҫІВПлУлјЩЙиЎҝ
ІВПл1ЈәҝЙТФҙъМжЈ¬ТтОӘГҫМхУлСхЖш·ҙУҰәуІ»»бІъЙъЖшМе
ІВПл2ЈәІ»ДЬҙъМжЈ¬ІйФДЧКБПЦӘҪрКфГҫәЬ»оЖГЈ¬ҝЙДЬ»бУлҝХЖшЦРөДөӘЖш·ҙУҰ
ЎҫҪшРРКөСйЎҝ
ІҪЦи | КөСйІЩЧч | КөСйПЦПу |
ўс | ЧйЧ°әГЧ°ЦГәуЈ¬ҙтҝӘЦ№Л®јРЈ¬КЦОжјҜЖшЖҝЈ¬Т»¶ОКұјдәуЈ¬ЛЙҝӘКЦ | ЙХұӯЦРөј№ЬҝЪУРЖшЕЭГ°іцЈ¬ЛЙКЦәуЈ¬ЙХұӯЦРөј№ЬД©¶ЛУРТ»¶ОТәЦщ |
ўт | №ШұХЦ№Л®јРЈ¬өгИјГҫМхЈ¬СёЛЩЙмИлјҜЖшЖҝЦРЈ¬ИыәГИыЧУ | ГҫМхИјЙХЈ¬·ЕіцҙуБҝИИЈ¬·ўіцТ«СЫ°Ч№вЈ¬ЙъіЙҙуБҝ°ЧСМЈ¬КЈУа№ММеОӘ°ЧЙ«ҙшЧҙОп |
ўу | АдИҙЦБКТОВЈ¬ҙтҝӘЦ№Л®јР | ЙХұӯЦРЛ®ҙУөј№ЬҪшИлјҜЖшЖҝЦРЈ¬Ме»эФјОӘјҜЖшЖҝМе»эөД2/5 |
ЎҫҪвКНУлҪбВЫЎҝ
ЈЁ1Ј©MgУлСхЖш·ҙУҰөД»ҜС§·ҪіМКҪОӘ_________ЎЈ
ЈЁ2Ј©ІҪЦиўсЛөГчЧ°ЦГөДЖшГЬРФ_________ЎЈ
ЈЁ3Ј©ІҪЦиўтЦРЈ¬№ШұХЦ№Л®јРөДДҝөДКЗ_________ЎЈ
ЈЁ4Ј©НЖІвІВПл2іЙБўөДПЦПуЦӨҫЭКЗ_________ЎЈ
Ўҫ·ҙЛјУлЖАјЫЎҝ
ЈЁ5Ј©ёГРЎЧйИПОӘЈ¬јҙК№ІҪЦиўуЦРЛ®өДМе»эЗЎәГХјјҜЖшЖҝМе»эөД1/5Ј¬ТІІ»ДЬЛөГчІВПл1іЙБўЈ¬АнУЙКЗ_________ЎЈ
ЈЁ6Ј©РЎЧйЦРН¬С§¶ФГҫМхУлЖҝЦРЖшМеөД·ҙУҰМбіцБЛҪшТ»ІҪөДІВПлЈәјЧН¬С§ИПОӘГҫМхПИУлO2·ҙУҰЈ¬ТТН¬С§ИПОӘГҫМхПИУлN2·ҙУҰЎЈОӘҪшТ»ІҪјмСйЛыГЗөДІВПлЈ¬ҝЙТФҪшРРөДКөСйІЩЧчКЗЈәИЎЙЩБҝГҫМхЈ¬өгИјәуСёЛЩ·ЕИлКўУРҝХЖшөДјҜЖшЖҝЦРЈ¬ҙэГҫМхПЁГрәуЈ¬________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәіхЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝУТНјКЗјЧЎўТТБҪЦЦ№ММеОпЦК(І»ә¬Ҫбҫ§Л®)өДИЬҪв¶ИЗъПЯЎЈПВБРЛө·ЁХэИ·өДКЗ
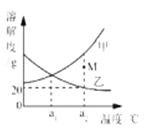
AЈ®јЧөДИЬҪв¶ИҙуУЪТТөДИЬҪв¶И
BЈ®a1ЎжКұЈ¬јЧЎўТТұҘәНИЬТәөДОВ¶ИЙэОВЦБa2ЎжКұЈ¬ҫщУР№ММеОціц
CЈ®a2ЎжКұЈ¬Mөг¶ФУҰөДјЧИЬТәІ»ұҘәН
DЈ®a2ЎжКұЈ¬ТТұҘәНИЬТәөДЦКБҝ·ЦКэОӘ20%
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәіхЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝФЪІв¶ЁҝХЖшЦРСхЖшә¬БҝөДКөСйЦРЈЁИзПВНјЛщКҫЈ©Ј¬ФміЙјҜЖшЖҝЦРЛ®өДМе»эі¬№э 1/5 өДФӯТтКЗЈЁ Ј©
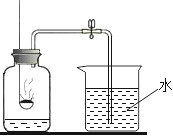
A. Ч°ЦГВ©Жш
B. әмБЧБҝІ»Чг
C. ОҙАдИҙөҪКТОВҫНҙтҝӘөҜ»ЙјРЈ¬ИГЛ®ҪшИлјҜЖшЖҝ
D. әмБЧИјЙХКұОҙјРҪфөҜ»ЙјРЈ¬ИГЖҝЦРЖшМеКЬИИЕЬіцИҘБЛ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәіхЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПЦУРAЎўBЎўCЎўDЎўEЎўFЎўGЎўHЎўIҫЕЦЦіхЦР»ҜС§іЈјыөДОпЦКЈ¬іЈОВПВЈ¬AЎўB¶јКЗОЮЙ«ТәМеЗТЧйіЙФӘЛШПаН¬Ј¬CЎўDОӘЖшМеөҘЦКЈ¬EОӘәЪЙ«№ММеЈ¬FЎўIКЗіЈјыөДОЮЙ«ЖшМеЗТҫЯУРПаН¬ЧйіЙФӘЛШЈ¬GОӘҙуАнКҜөДЦчТӘіЙ·ЦЈ¬HКЗТ»ЦЦІ»ОИ¶ЁөДЛбРФОпЦКЈ¬ЛьГЗЦ®јдЧӘ»Ҝ№ШПөИзНјЛщКҫЈ®»ШҙрПВБРОКМвЈә
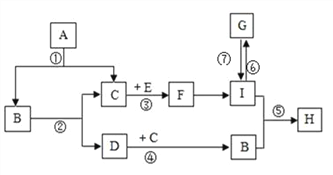
(1)Рҙіц»ҜС§КҪЈәA____Ј¬H______Ј®
(2)Рҙіц»ҜС§·ҪіМКҪЈә
·ҙУҰўЩ__________________Ј¬ўЪ__________________
ЖдЦРўЩөД»щұҫ·ҙУҰАаРНКЗ__________________________
(3)·ҙУҰўЭФЪ№ӨТөЙПөДУГНҫКЗ__________________Ј®
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәіхЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝФД¶БПВГжҝЖЖХ¶МОД(ФӯОДУРЙҫёД)
КіСО
КіСОКЗЙъ»оЦРіЈУГөДөчО¶Ж·Ј¬ЦчТӘіЙ·ЦКЗВИ»ҜДЖЈ¬ФЪИЛМеЦРУРөчҪЪЛ®·ЦЎўО¬іЦЛбјоЖҪәвөИЙъАнЧчУГЎЈ
ЧКБПТ»ЈәКіСОөДјУ№Ө
№ӨТөЙПУГәЈЛ®Й№СО»тУГСОәюЛ®ЎўСОҫ®Л®ЦуСОЈ¬К№ВИ»ҜДЖҫ§МеОціцЎЈХвСщЦЖөГөДВИ»ҜДЖә¬УРҪП¶аөДФУЦКЈ¬іЖОӘҙЦСОЎЈҙЦСОҫӯПВНјЛщКҫЦчТӘБчіМҝЙіЙОӘҫ«СОЎЈ

ЧКБП¶юЈәКіСОөДЦЦАа
КРГжЙПКіСОЦЖЖ·ЦЦАа·ұ¶аЈ¬ПЦјтТӘҪйЙЬјёЦЦЎЈФӯСОЈ¬јҙҙЦСОЈ¬іЈУГУЪлзЦЖ№ӨТХЈ»ҫ«СОЈ¬УЙҙЦСОМбҙҝ¶шіЙЈ¬ККәПЕлвҝөчО¶Ј»өвСОЈ¬ФЪКіСОЦРМнјУТ»¶ЁБҝөвЛбјШ(KIO3)јҙОӘөвСОЈ¬ҝЙ·АЦОөвИұ·ҰІЎЈ»өНДЖСОЈ¬КіСОЦРМнјУВИ»ҜјШЎўБтЛбГҫөИУРЎ°ПМО¶ЎұөДіЙ·ЦЈ¬ҝЙ·АЦОТтДЖАлЧУЙгИл№э¶а¶шТэЖрөДёЯСӘС№өИјІІЎЎЈ
ЧКБПИэЈәКіСОөДЙгИлБҝ
ЛдИ»ОТГЗөДЙнМеАлІ»ҝӘКіСОЈ¬ө«ЙгИл№э¶аТІ»б¶ФЙнМеІъЙъОЈәҰЎЈ°ҙХХКАҪзОАЙъЧйЦҜөДНЖјцұкЧјЈ¬іЙИЛГҝМмКіСОЙгИлБҝІ»ТЛі¬№э6gЎЈИ»¶шҫЭөчІйЈ¬ОТ№ъИЛҫщГҝМмөДКіСОЙгИлБҝОӘ9.1gЎЈТ»·ҪГжИэІНЦРКіСОБҝРиТӘҝШЦЖЈ¬БнТ»·ҪГжЈ¬Рн¶аіЙЖ·КіОпЦРКіСОөДә¬БҝТІУҰТэЖрЦШКУЈ¬ПВұнЛщКҫОӘІҝ·ЦіЙЖ·КіОпГҝ100gЦРөДКіСОә¬БҝЎЈ
КіЖ· | ДіЖ·ЕЖ·ҪұгГж | ДіЖ·ЕЖҪҙУН | ДіЖ·ЕЖКнЖ¬ |
КіСОә¬Бҝg/100g | 3 | 16 | 1.6 |
ТАҫЭОДХВДЪИЭ»ШҙрПВБРОКМвЎЈ
(1)УЙҙЦСОЦЖөГҫ«СОөД№эіМКфУЪ_________(МоЎ°ОпАнЎұ»тЎ°»ҜС§Ўұ)ұд»ҜЎЈ
(2)іЙИЛГҝМмКіСОЙгИлБҝІ»ТЛі¬№э_____________gЎЈ
(3)Из№ыДіИЛТ»МміФБЛБҪҙь(№І300g)ЙПұнЦРЛщКҫ·ҪұгГжЈ¬°ҙХХКАҪзОАЙъЧйЦҜНЖјцұкЧјЈ¬ЖдөұМмКіСОЙгИлБҝ________(МоЎ°і¬ұкЎұ»тЎ°Оҙі¬ұкЎұ)ЎЈ
(4)ПВБР№ШУЪКіСОөДЛө·ЁХэИ·өДКЗ_________ЎЈ
AЈ®ёЯСӘС№»јХЯЈ¬ҝЙККөұСЎФсөНДЖСО
BЈ®ДҝЗ°ОТ№ъҫУГсКіСОЙгИлБҝЖХұйЖ«ёЯ
CЈ®ВИ»ҜДЖКЗО¬іЦИЛМеЙъГь»о¶ҜөДЦШТӘОпЦК
DЈ®ОӘІ№ідИЛМеЛщРиДЖФӘЛШәНВИФӘЛШЈ¬ГҝМмЧц·№КұҝЙјУИлҙуБҝКіСО
(5)ЗлДгОӘИЛГЗМбТ»МхИХіЈЙгИЎКіСОөДҪЁТйЈә_________________________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәіхЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝҝОНвКөСйЈәЎ°Т¶ВцКйЗ©Ўұ(ИзНј)өДЦЖЧч№эіМКЗҪ«ПҙёЙҫ»өДКчТ¶·ЕФЪТ»¶ЁЕЁ¶ИөДЗвСх»ҜДЖИЬТәЦРЦу·РЈ¬ФЩјУТФҙҰАнЈ¬іэИҘұнЖӨәНТ¶ИвЈ¬Ц»УаЗеОъөДТ¶ВцЈ¬ҫНДЬөГөҪЎ°Т¶ВцКйЗ©ЎұЎЈКөСйРЎЧйН¬С§¶ФёГЦЖЧч№эіМј°ЗвСх»ҜДЖөДРФЦКҪшРРБЛСРҫҝЎЈ

IЈ®МҪҫҝЦЖЧчЎ°Т¶ВцКйЗ©ЎұөДЧојСМхјю
ЎҫІйФДЧКБПЎҝ
ЗвСх»ҜДЖИЬТәУРёҜКҙРФЎЈ
ЎҫҪшРРКөСйЎҝ
КөСй1ЈәПаН¬Цу·РКұјдДЪЈ¬Ҫ«ПҙёЙҫ»өДКчТ¶·ЕФЪІ»Н¬ЕЁ¶ИөДЗвСх»ҜДЖИЬТәАпЈ¬ҙҰАнәуТ¶Ж¬ұд»ҜИзПВұнЎЈ
NaOHИЬТәЕЁ¶И | 1% | 5% | 10% |
Т¶Ж¬ұд»Ҝ | БфУРәЬ¶аТ¶Ив | БфУРҪП¶аТ¶Ив | ІРБфәЬЙЩТ¶Ив |
КөСй2ЈәФЪ10%өДЗвСх»ҜДЖИЬТәАпЈ¬Ҫ«ПҙёЙҫ»өДКчТ¶ҪшРРІ»Н¬КұјдөДЦу·РЈ¬ҙҰАнәуТ¶Ж¬ұд»ҜИзПВұнЎЈ
Цу·РКұјд | 5min | 15min | 20min |
Т¶Ж¬ұд»Ҝ | БфУРҪП¶аТ¶Ив | ІРБфәЬЙЩТ¶Ив | Т¶Ж¬ҫнЖрАҙЈ¬Т¶ИвУлТ¶ВцІ»ТЧ·ЦАл |
ЎҫҪвКНУлҪбВЫЎҝ
(1)КөСй1өДКөСйДҝөДКЗ_______________ЎЈ
(2)КөСйРЎЧйͬѧѡФсБЛ10%өДЗвСх»ҜДЖИЬТәЦЖЧчЎ°Т¶ВцКйЗ©ЎұЈ¬ФӯТтКЗ___________ЎЈ
(3)НЁ№эКөСй2ҝЙЦӘЈ¬ЦЖЧчЎ°Т¶ВцКйЗ©ЎұөДЧојСЦу·РКұјдКЗ__________(МоЧЦДёРтәЕ)ЎЈ
AЈ®5min BЈ®15min CЈ®20min
IIЈ®МҪҫҝЗвСх»ҜДЖөДРФЦК
ЎҫІйФДЧКБПЎҝ
a.ЗвСх»ҜДЖУлЗвСх»ҜёЖ»ҜС§РФЦКПаЛЖ
b.ПЎСОЛбУлМјЛбДЖ(Na2CO3)·ҙУҰөД»ҜС§·ҪіМКҪОӘЈә2HCl + Na2CO3==2NaCl + H2O +CO2Ўь
c.НЁіЈЧҙҝцПВЈ¬1Ме»эөДЛ®ФјДЬИЬҪв1Ме»э¶юСх»ҜМј
ЎҫІВПлУлјЩЙиЎҝ
(4)ЗвСх»ҜДЖДЬУл¶юСх»ҜМј·ўЙъ·ҙУҰЈ¬Жд»ҜС§·ҪіМКҪОӘЈә2NaOH +CO2==Na2CO3 +_________
ЎҫҪшРРКөСйЎҝ
КөСйІҪЦи | КөСйПЦПу |
| ОЮГчПФұд»Ҝ |
јЧН¬С§·ўПЦКөСйІҪЦиўЩЦРОЮГчПФұд»ҜЈ¬ІъЙъТЙОКЈәБҪЦЦОпЦККЗ·с·ўЙъБЛ»ҜС§·ҙУҰЈҝФЪАПКҰөД°пЦъПВЈ¬НЁ№э¶ФұИКөСйІҪЦиўЪўЫЦӨГчNaOHУл¶юСх»ҜМј·ўЙъБЛ·ҙУҰЎЈ
КөСйІҪЦи | КөСйПЦПу |
| AЦРУРҙуБҝЖшЕЭІъЙъЈ¬ BЦР____________ЎЈ |
| ОЮГчПФұд»Ҝ |
ЎҫҪвКНУлҪбВЫЎҝ
(5)ІҪЦиўЪЦРНЁ№эBЦРКөСйПЦПуЈ¬ҝЙЦӘПЎСОЛбјУИлөҪІҪЦиўЩЛщөГИЬТәЦРУР¶юСх»ҜМјІъЙъЎЈ
(6)КөСйўЫөДДҝөДКЗЕЕіэ________________өДёЙИЕЎЈ
(7)ТТН¬С§ИПОӘУГИнЛЬБПЖҝТІҝЙТФСйЦӨЗвСх»ҜДЖУл¶юСх»ҜМјөД·ҙУҰЈ¬РиТӘ¶ФұИөДКөСйЧ°ЦГУР__________(МоЧЦДёРтәЕ)ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәіхЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝКөСйКТУРТ»°ьә¬УРЙЩБҝВИ»ҜДЖФУЦКөДПхЛбјШ№ММеЈ¬ОӘМбҙҝПхЛбјШЈ¬ЙијЖИзПВНјЛщКҫІЩЧчЈ¬
![]()
УР№Ш·ЦОцЦРХэИ·өДКЗ
A. ІЩЧчўсЎ«ўу·ЦұрКЗјУИИЕЁЛхЎўХф·ўҪбҫ§Ўў№эВЛ
B. ІЩЧчўсКЗ№эВЛЈ¬Ҫ«ВИ»ҜДЖ№ММеҙУИЬТәЦР·ЦАліэИҘ
C. ІЩЧчўтКЗјУИИЕЁЛхЈ¬іГИИ№эВЛЈ¬іэИҘФУЦКВИ»ҜДЖ
D. ІЩЧчўуКЗ№эВЛЈ¬Ҫ«ПхЛбјШҫ§МеҙУИЬТәЦР·ЦАліцАҙ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәіхЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝЛ®КЗТ»ЦЦЦШТӘөДЧКФҙЎЈЗл»ШҙрПВБРОКМвЈә
ўЩ »оРФМҝіЈУГУЪҫ»Л®Ј¬ЦчТӘАыУГЖд___________РФЎЈ
ўЪ УГАҙјмСйОЮЛ®ҫЖҫ«ЦРКЗ·сә¬УРЛ®өДОпЦККЗ____________ЎЈ
ўЫ ҙтҝӘЖыЛ®ЖҝёЗКұЈ¬ЖыЛ®»бЧФ¶ҜЕзіцАҙЈ¬ЛөГчЖшМеФЪЛ®ЦРөДИЬҪв¶ИЛж_______¶шјхРЎЎЈ
ўЬ ФЪәк№ЫЎўОў№ЫәН·ыәЕЦ®јдҪЁБўБӘПөКЗ»ҜС§МШУРөДЛјО¬·ҪКҪЎЈ
ўЭ Л®КЗТ»ЦЦЦШТӘөДИЬјБЈ¬ЕдЦЖ100gИЬЦКЦКБҝ·ЦКэОӘ16ЈҘөДВИ»ҜДЖИЬТәЈ¬ЛщРиЛ®өДМе»эОӘ_______mLЈЁЛ®өДГЬ¶ИКЗ1.0g/cm3Ј©Ј»ИЬҪвКұІЈБ§°фҪБ°иөДДҝөДКЗ__________ЎЈ
ўЮ јЧЎўТТБҪЦЦ№ММеОпЦКЈЁІ»ә¬Ҫбҫ§Л®Ј¬ЗТІ»УлЛ®·ҙУҰЈ©өДИЬҪв¶ИЗъПЯИзПВНјЎЈ
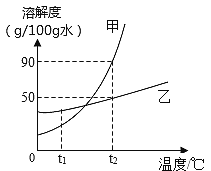
ЈЁIЈ©јЧЎўТТБҪЦЦОпЦКЦРИЬҪв¶ИКЬОВ¶ИУ°ПмҪПҙуөДКЗ___________ОпЦКЎЈ
ЈЁўтЈ©ИфҪ«t2ЎжКұјЧөДІ»ұҘәНИЬТәұдіЙёГОВ¶ИПВөДұҘәНИЬТәЈ¬ҝЙІЙУГөД·Ҫ·ЁКЗ_________ЎЈЈЁИОРҙТ»ЦЦјҙҝЙЈ©
ЈЁўуЈ©ИфјЧОпЦКЦР»мУРЙЩБҝөДТТОпЦКЈ¬МбҙҝјЧОпЦКҝЙІЙИЎөД·Ҫ·ЁКЗ____________ЎЈ
ЈЁIVЈ©t1ЎжКұЈ¬ИфҪ«25gТТ№ММејУИл50gЛ®ЦРЈ¬ід·ЦҪБ°иәуЈ¬ИФУР9.2gТТ№ММеОҙИЬҪвЈ¬Фтt1ЎжКұТТөДИЬҪв¶ИОӘ______ЎЈ
ЈЁVЈ©t2ЎжҪУҪьұҘәНөДјЧИЬТәЦрҪҘАдИҙЦБt1ЎжЈ¬ПВНјЦРУР№ШБҝЛжКұјдұд»ҜөДЗчКЖХэИ·өДКЗ________ЎЈЈЁСЎМоұаәЕЈ©

Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com